LF対談
流行には乗らずに。基本に忠実に。 No.106(2025.10)

京都大学 プロボスト理事・副学長
岩井一宏 氏
公益財団法人 千里ライフサイエンス振興財団
審良静男 理事長
鉄代謝における分解機構の研究から
ユビキチン・プロテアソーム系に関心
審良 今回は、直鎖状ポリユビキチン鎖の発見者である岩井一宏先生を迎えました。
岩井 お招き、ありがとうございます。
審良 まず京都大学医学部に入学された経緯からうかがいます。
岩井 正直に言うと、工学部に行きたかったんです。でも私は、京大医学部の敷地の目と鼻の先にある家で育ち、祖父も父も京大医学部出身。そんな環境なので、家では「お前、医学部やな」と言われていまして。
もう一つ、高校1年のときその父が糖尿病で透析治療を受けだして、母から「あんた、医者になってくれへんかったら私、困る」と言われましてね。
審良 医学部卒業後は、内科医としてリウマチ膠原病の診療に当たられたそうですね。
岩井 ええ。京大の医学部北門まで家から3分、京大病院まで7分ですから、遠くへ行きたいと思って、1985年に神戸市立中央市民病院の内科研修医になりました。医者の仕事はおもしろかったのですが、対症療法的な治療が多く、やっぱり病因に迫れる仕事がしたいなと。それで医学部時代の先輩から「膠原病はおもしろそうや」と言われ、1987年より京大の大学院に行きました。井村裕夫先生の「第二内科」です。実験を京大の胸部疾患研究所の桂義元さんのところでやっていたのですが、そこに自治医科大学助教授だった湊長博さん(現・京都大学総長)がよくお見えになられて、京大の教授になられることになり「半年だけ助手しなさいよ」と言われ、博士課程修了後そうなりました。
審良 その半年を経て、1993年に米国国立衛生研究所(NIH)に留学されたのですよね。
岩井 はい。当時NIHにいたリチャード・クラウスナーさんのラボに所属しました。
審良 なぜ、そのラボを選んだのですか。
岩井 T細胞抗原受容体のシグナリングの研究をしたかったんです。ところがクラウスナーさんから、その研究はもうやめていて、小胞・ゴルジ体の研究と鉄代謝の研究をしていると。意に反して「鉄をやれ」と言われたのですが、私と同学年で薬学部出身だった妻の就職事情もあり、二人とも雇ってもらえるこのラボに入りました。周囲から「膠原病でリンパ球を見てたのに、つぎは鉄代謝で赤血球か」と言われました(笑)。
審良 鉄代謝の研究はいかがでしたか。
岩井 やったことがなかったからおもしろかったですね。鉄のことを当時だれも理解していなかったのもある意味よかったです。
審良 どんな研究をされたのですか。
岩井 鉄調節タンパク質2(IRP2)という、鉄応答性エレメント(IRE)と結合して鉄の濃度を調整するタンパク質の制御機構です。鉄がないときIRP2はIREと結合することが知られていましたが、私は鉄があるときIRP2は分解されることを見つけました。
では、そのIRP2の分解はなんで起きるかというと、ユビキチン化されたタンパク質を選択的に分解する巨大な酵素複合体のプロテアソームのはたらきによってです。
審良 ここで先生の代表的な研究テーマ「ユビキチン」が出てくるのですね。当時のプロテアソーム研究の状況は……。
岩井 1991年には、サイクリンがユビキチン系で分解されることがわかり、私が留学していた1990年代の中頃には機能が次々と明らかになっていました。ユビキチン・プロテアソーム系がタンパク質の分解に重要だと知られるようになり、私も「これ研究したら飯を食えるかも」と思うようになりました。
「なんでずれてんねん」
という疑問から
直鎖状ポリユビキチン鎖を発見
審良 みんなユビキチン鎖はユビキチンのリジン残基を介して形成されるとばかり思っていたなか、岩井先生はそれを疑い、ついに直鎖状ポリユビキチン鎖の発見に至りましたね。どんな経緯だったのでしょう。
岩井 留学先でのIRP2が分解されるときに関わるHOIL-1という遺伝子を見つけていました。調べると、多くの細胞ではHOIL-1のオルタナティブスプライシング産物であるHOIL-1Lが存在しており、「なにをしているのやろ」と、ゲル濾過をしてみたのです。すると、HOIL-1Lのタンパク質が大きな複合体をつくっているのがわかりました。「この複合体の正体はなんなんや」とさらに調べると、HOIL-1Lのほか、HOIPというタンパク質が見えてきて、ユビキチンをつなぐユビキチンリガーゼの活性中心をもっているとわかりました。ユビキチン結合モチーフもいっぱいあって「なんでや」と。
ユビキチン鎖がどうやってできるかに立ちかえると、活性化酵素のE1、結合酵素のE2、そしてユビキチン鎖を付加するユビキチンリガーゼのE3という三つの酵素のはたらきがあります。でも、当時のユビキチン鎖の生成機構の図は「どうもおかしい」。ユビキチン鎖が伸長するにつれ、活性中心の空間的位置がずれていってしまう。「生化学的にこんな不気味なことないやろ」と。
審良 私もそう思っていましたが、「ずれてもいいんだ」としか考えていませんでした。教科書にそう書いてあったから。
岩井 私は気になって。それで思ったのが、HOIL-1LやHOIPからなる複合体が、そのユビキチン結合モチーフで、ポリユビキチン鎖の遠位端のユビキチン基質を識別して、E2からのユビキチンの転移を触媒すれば、ポリユビキチン鎖が伸長しても活性中心の空間的位置は変わらないだろう、ということです。この複合体がユビキチンを認識する部位をもっているのだから、ユビキチンを伸ばしていくのではないか、と。それで、実験をしました。N末端にユビキチンを付加した緑色蛍光タンパク質(GFP)と、単なるGFPを基質として試験管内で反応を見たところ、この複合体は前者にのみユビキチンを付加し、伸ばしていったのです。
ユビキチンのリジン残基をぜんぶなくした場合どうなるかも見てみました。やはりユビキチンを伸ばしました。
審良 リジンは関係ないとなったのですね。
岩井 そうです。さらに、ユビキチンのN末端をメチル化によりブロックしたところ、ユビキチンは伸びていきませんでした。N末端の位置をずらしても、ユビキチンはユビキチンと結合しません。こうして、この複合体はユビキチンのN末端にのみユビキチンを付加するということがわかってきたのです。こうしてできるユビキチン鎖を「直鎖状ポリユビキチン鎖」、これを生成する複合体を「LUBAC」と名づけました。
審良 発表は2006年ですか。ユビキチン伸長はリジン残基を介してなされるというのが常識だったから叩かれたりしたのでは……。
岩井 叩かれるのには慣れてます(笑)。ユビキチン研究者コミュニティは発展途上にあったので、「まあ、そんなこともあるのかもな」と受け流してもらえましたね。
NF-κB活性化するしくみを解明
研究者との論争を乗りこえて
審良 ユビキチンというと、それまでタンパク質を分解する機能がよく知られていました。一方、発見なさった直鎖状ポリユビキチン鎖には、ほかの機能があることを岩井先生は解明されていきましたね。
岩井 はい。LUBACによって生成される直鎖状ポリユビキチン鎖は、NF-κBの活性化に関与することを解明しました。
審良 NF-κBは、免疫反応などで中心的役割を果たす転写因子ですね。
岩井 はい。直鎖状ポリユビキチン鎖を発見できたので、次どうしたらと思っていたとき、私たちが最初にとったHOIL-1Lに結合するタンパク質がNF-κBに関与するという論文が出たのです。当時は大阪市立大学(現・大阪公立大学)にいたころで、隣の研究室にいた免疫研究者の中嶋弘一さんにレポーター遺伝子をもらって実験してみました。すると、LUBACがNF-κBを特異的に活性化するデータを出せました。NF-κBは細胞質に存在しますが、LUBAC発現細胞でのみ核に移行したのです。
でも大変でした。当時すでに、ユビキチンの63番目のリシンを介して形成されるK63鎖が、NF-κBの活性化に寄与しているという話になっていたので……。
審良 陳志堅(ジェームズ・チェン)氏による報告ですよね。強力ですもんね、彼は。
岩井 会うといつも論争になって。「お前はまちがっている」とまで言われました。けれども、NEMOがユビキチン結合モチーフになるということがわかりだして、NEMOはK63鎖と親和性が極めて低く、直鎖との親和性のほうが100倍ほど高いというデータも出てきて、構造生物学者たちが、NF-κBの活性化に関与するのは直鎖状ポリユビキチン鎖のほうではと言いだしたのです。ジェームズも静かになっていきました
。
審良 その後はどう研究を進めたのですか。
岩井 LUBACのサブユニットとして、HOIL-1LやHOIPのほか、もう一つSHARPINというサブユニットを同定しました。SHARPINは、慢性皮膚炎などを起こすcpdmマウスの責任遺伝子産物だとわかっていました。この三つの複合体がLUBACであるとしました。
審良 HOIL-1L、HOIP、SHARPINはそれぞれどのような役割をもっているのですか。
岩井 HOIPが活性中枢なのですが、HOIL-1LとSHARPINと三つあってはじめて安定化します。SHARPINは、安定化のためだけに機能します。それと、HOIL-1Lのユビキチンリガーゼ(RBR)のドメインに機能があることが後にわかってきました。
審良 HOIPにもRBRドメインがあるみたいだから、二重に酵素活性をもっている……。
岩井 そこが謎でした。HOIL-1LのRBRをなくしてやると、直鎖状ポリユビキチン鎖の量が非常に増えたのです。要は、活性を調整しているわけです。LUBACでは、活性中心のサブユニットのHOIPでなく、アクセサリーサブユニットのHOIL-1Lにより機能制御されているという機構がわかりました。

岩井一宏 氏
京都大学 プロボスト理事・副学長
1959年、京都府生まれ。85年京都大学医学部を卒業。85〜87年神戸市立中央市民病院内科研修医。92年京都大学大学院医学研究科医学専攻博士課程を修了。京都大学医学部助手。93年米国国立衛生研究所(NIH)研究員。96年京都大学大学院医学研究科助手。97年京都大学大学院医学研究科助教授。99年京都大学大学院生命科学研究科助教授。2001年大阪市立大学大学院医学研究科教授。08年大阪大学大学院生命機能研究科/医学系研究科教授。12年京都大学大学院医学研究科教授。18年京都大学大学院医学研究科長・医学部長。22年より現職。専門分野は生化学、細胞生物学、分子生理学。直鎖状ポリユビキチン鎖と同鎖を生成する酵素複合体LUBACの発見・解明などで世界的に知られる。ユビキチン研究のほか、米国NIH研究員時代よりおこなっている鉄代謝関連の研究にも従事する。おもな受賞歴は、日本医師会医学賞、持田記念学術賞、武田医学賞、上原賞、日本学士院賞。趣味は温泉めぐり。
LUBAC、直鎖状ポリユビキチン鎖と
各種疾患の関係性を明らかに
審良 その後はどうされましたか。
岩井 病気関連の話がいっぱいきましてね。
まず、子どもの免疫不全などの研究をしているパオラ・マルコ-カサノヴァ博士のグループから突然メールをいただき、LUBACの構成成分の変異がヒトの免疫不全や自己炎症性疾患の患者たちに集積しているとのことでした。調べてみると、LUBACのサブユニットのHOIL-1L、HOIP、SHARPINいずれの異常も免疫不全につながることがわかりました。
審良 三つとも正常に機能しないと、ユビキチンが形成されず、NF-κBの活性化が正常に起きないということでしょうね。
先生が医者をされていたとき診療された膠原病関連でも研究は進みましたか。
岩井 最近、膠原病の一種の全身性エリテマトーデスやシェーグレン症候群の関連でわかってきたことがあります。さきほど、LUBACの機能はHOIL-1Lに制御されていると話しましたが、HOIL-1Lの酵素欠損が、直鎖状ポリユビキチン鎖の生成を亢進し、これらの疾患を発症することがわかったのです。審良先生は免疫の研究者だから、抗体価が高まってリンパ球の機能が上がるのは膠原病っぽいって感じられると思います。
審良 そうですね。
岩井 ヒトでもHOIL-1Lの酵素欠損がSLEなどにつながるかが気になりました。一つのアミノ酸を換えるだけでHOIL-1Lの酵素活性がなくなるので、一塩基変異があるだろうかと思っていると、理化学研究所ゲノム解析応用研究チームの寺尾知可史さんにデータをいただけました。調べてみるとHOIL-1LにR464Hというアミノ酸置換を生じる一塩基の変異で直鎖状ポリユビキチン鎖の生成が亢進することを見いだせたのです。この一塩基変異は、HOIL-1LのRBCK1遺伝子におけるものであり、この遺伝子がSLEの疾患感受性遺伝子であることを示せました。
審良 なにかを制御しているようなしくみが失われると、病気になりやすいですよね。
鉄の研究への回帰
「どうやって鉄で死ぬんやろ」を胸に
審良 今後はどのような研究を……。
岩井 直鎖状ポリユビキチン鎖やLUBACの基本的な概念の探究は終わりかなと思っています。臨床応用については膠原病内科の先生たちにお任せしようという感じです。
ではどうするか。2004年のノーベル化学賞を受賞された一人のアブラム・ハーシュコさんが、「これからは、小さいけれど新しい貢献ができたら」といったようなことを話されていて、それがかっこよくて。私もと(笑)。で、なにをしているかというと、私のもう一つのテーマだった鉄の研究です。
審良 過去のテーマに戻ったんですか! 鉄への興味が残っておられたのですか。
岩井 医師でない優秀な教え子たちがいて、彼らの将来を考えてというのはあります。鉄の研究には未解明な部分がまだ多い。
審良 新しい成果がこれからも出やすい鉄の研究をすることにしたわけですね。どのような研究をされているのですか。
岩井 取り組んでいるのは、鉄依存性細胞死ともよばれる「フェロトーシス」についての研究です。流行っているからでなく、単純な疑問からです。「鉄で死ぬといっているけれど、どうやって鉄で死ぬんやろ。そんなことあるか」って。
それで、セレン代謝の制御にかかわるPRDX6という遺伝子を同定できました。セレンは特異的にタンパク質に取り込まれて、細胞死を制御する機能を発揮します。PRDX6のタンパク質は、これまで過酸化脂質を還元するといわれていたのですが、そうでなく、セレンを運搬しているというのがわかってきました。フェロトーシスの抑制因子GPX4などにセレンを運搬し、セレンタンパク質の合成を促進することで、フェロトーシスを抑制するのです。
審良 素朴な疑問から着手されたんですね。
岩井 「どうやって鉄で死ぬんやろ」という疑問からもう一つ、老化細胞を選択的に除去する「セノリシス」の研究もしています。老化細胞は、リソソーム膜の破綻が亢進して細胞死に至るというから、フェロトーシスのようなものと思っていました。ところが、私たちが調べてみると、老化細胞はフェロトーシス耐性であり、リソソームが破綻するようなことはありませんでした。
審良 そうなんですか。
岩井 ええ。じつは、老化細胞はリソソームのなかに鉄を蓄積しまくるのです。鉄をリソソーム内に蓄積して、使える鉄を減らしている。それで、培地の鉄の量をぎりぎりまで減らしてリソソームに鉄が蓄積されないようにしてみたら、リソソームはきれいで小さな形になりました。老化の形質がなくなったのです。
審良 つまり、老化とは、リソソームに鉄がたまることだ、と……。
岩井 おそらく、そうです。
ほかに、ユビキチンの研究と並行して進めてきた鉄代謝の研究もあります。鉄貯蔵タンパク質のフェリチンは、鉄欠乏のときは鉄を貯蔵してリソソームに輸送され、分解されて鉄を放出するのですが、鉄過剰のときもやはりリソソームに運ばれて分解されるのです。これらの機構でわかってきたのは、酸素分圧が高いときだけフェリチンがリソソームに輸送されるということ。肝臓では酸素分圧の高い門脈付近にリソソーム内の変性フェリチンであるヘモジデリンが多いこともわかりました。
若い人たちは、偶然や予想とちがう結果を見逃さず、やってくれています。
人とおなじ視線は嫌
流行に乗らない
審良 岩井先生が研究で心がけていることを聞かせていただけますか。
岩井 ほかの人とおなじ視線はイヤ。だから流行に乗るのはイヤで、基本に忠実な話をしようということを心がけてきました。
審良 今日のお話から、それがわかります。
岩井 ユビキチン発見の経緯自体そうだったんですよ。タンパク質の分解は、そもそも適切な酵素があれば進むはずでしょう。ところが、細胞内でわざわざエネルギーを使ってタンパク質を分解する系があるということが1953年に発表され、そんなことあるかと解析したら、ユビキチンの発見に至ったんです。基本的な問題をきちんと捉える姿勢は重要ではないでしょうか。
審良 疑問を見逃さないということですね。
日本のライフサイエンスの現状には、どんなことを思っておられますか。
岩井 いまの日本では研究者が安くこき使われている気がします。若い人たちに、研究者になることに夢を感じてもらいたい。おもしろそうだと思える研究に投資をする状況が増えてほしいと思います。
審良 今日はありがとうございました。
(対談日/2025年6月23日)
EYES
21世紀のユビキチン研究を大きく前進させた
「新たな鎖」の発見
直鎖状ポリユビキチン鎖の
生成酵素複合体LUBACの機能解明も
アミノ酸76個でできた翻訳後修飾タンパク質に「ユビキチン」があります。 1975年に発見され、真核生物に普遍的(ubiquitous)に存在することにちなんでユビキチンと命名されましたが、役割は不明でした。1978年以降、標的のタンパク質を修飾して分解に導くというユビキチンのはたらきがよく知られてきました。
1990年代、ユビキチンのタンパク質分解系の研究が進み、2004年には「ユビキチンが仲介するタンパク質分解の発見」により、アーロン・チカノーバー、アブラム・ハーシュコ、アーウィン・ローズの3氏にノーベル化学賞が贈られました。
しかし、その後もユビキチンの研究は大きく発展を遂げます。ユビキチンの分解以外の役割や、ユビキチン鎖の多様性などが次々と明らかになっていったのです。
2000年代以降のユビキチン研究の発展に大きく貢献した一人が、岩井一宏氏です。岩井氏のユビキチンをめぐる研究の歩みは、研究者たちのユビキチンに対する通念をうち破るようなインパクトあるもので始まりました。
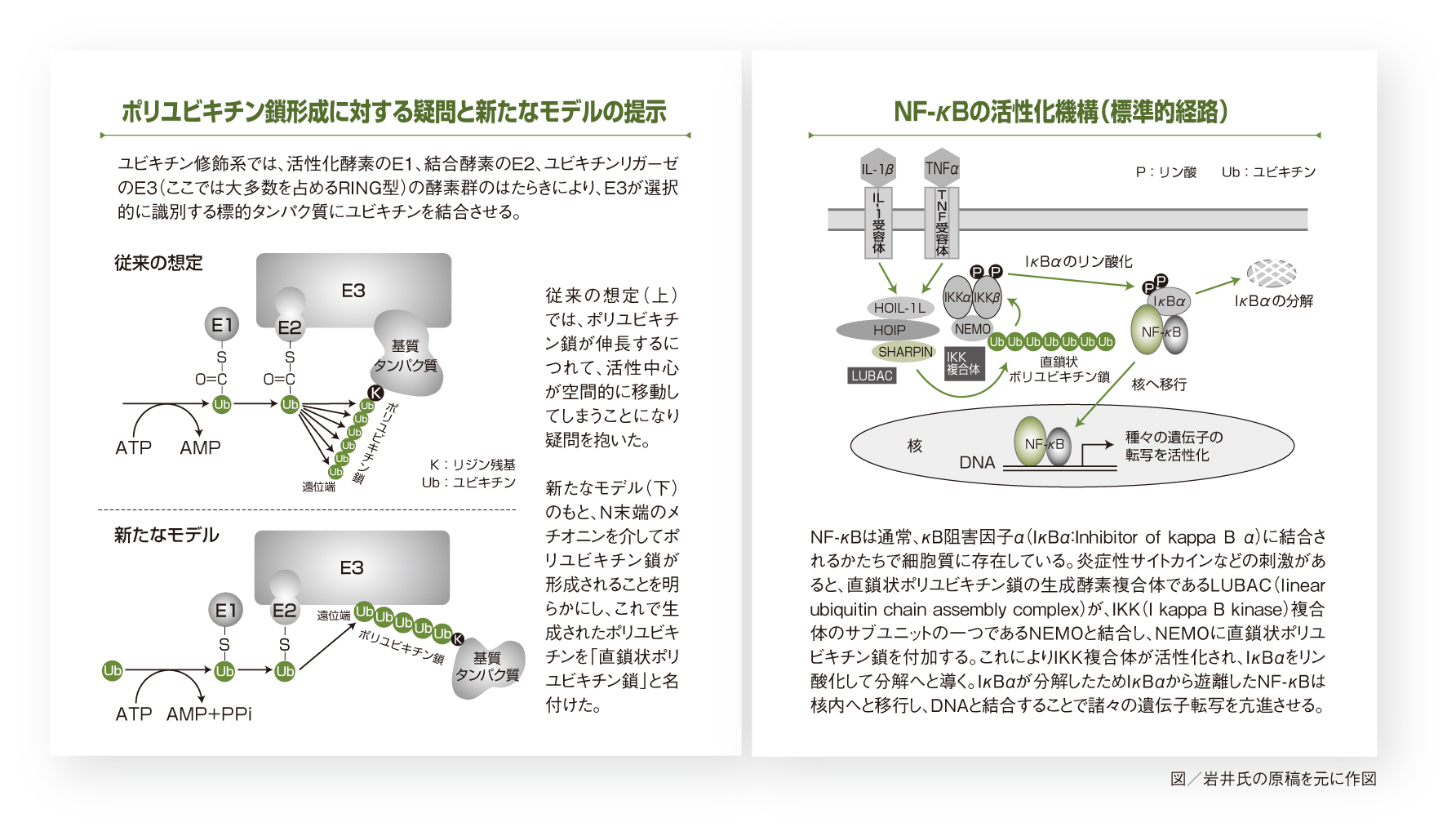
2000年代初頭、ユビキチン鎖はユビキチンに存在するリジン残基とよばれる部分のいずれかを介して形成され、鎖の遠位端に一つずつユビキチンを結合させることで伸長すると考えられてきました。しかし、岩井氏は、この形成のされ方に「生化学的におかしい」と本質的な疑問を抱き、解析を進めます。その結果、岩井氏は2006年、リジン残基でなく、N末端のメチオニンという場所を介して伸長するユビキチン鎖があることを発見し、これを「直鎖状ポリユビキチン鎖」と命名しました(上左図)。直鎖状ポリユビキチン鎖は、真核生物のなかで動物界にのみ存在することから、進化の過程で出現したユビキチン鎖とみられます。
直鎖状ポリユビキチン鎖はどのように生成されるのか。岩井氏は、米国留学時代にとりくんでいた鉄代謝の研究で扱っていたHOIL-1という遺伝子・タンパク質への着目をきっかけに、その類似タンパク質であるHOIL-1L(Heme-oxidized IRP2 ubiquitin ligase 1L)、そしてHOIP(HOIL-1L-interacting protein)、さらにSHARPIN(Shank-associated RH domain-interacting protein)という3種のサブユニットから構成される酵素複合体こそが直鎖状ポリユビキチン鎖を生成することを明らかにしました。この複合体を、LUBAC(linear ubiquitin chain assembly complex)と命名します。
直鎖状ポリユビキチン鎖・LUBACの機能の解析にも岩井氏は乗りだします。そして、直鎖状ポリユビキチン鎖が、転写因子の一つである核内因子κB(NF-κB:nuclear factor-kappa B)の活性化に関与していることを解明します。NF-κBは、炎症性サイトカインなどのさまざまな刺激を受けると活性化し、諸々の遺伝子の発現を亢進させることで、免疫応答、炎症、細胞生存などの生理作用を発揮します。その活性化経路は、標準的経路と代替経路という二つに大きく分けられますが、直鎖状ポリユビキチン鎖は前者の経路に関与することを岩井氏は明らかにしました(上右図)。
岩井氏は、直鎖状ポリユビキチン鎖・LUBACと疾患の関係も明らかにしています。遺伝子異常によりLUBACが著減したマウスでは、NF-κBの活性化が弱まることで免疫不全が、また細胞死の亢進によって自己炎症性疾患様症状が引き起こされることを発見しました。この発見を契機として、ヒトにおいてLUBACのサブユニットの変異から自己炎症性症候群様と免疫不全を示す先天性疾患が引き起こされることも明らかになっています。また、直鎖状ポリユビキチン鎖のシグナルの抑制不全が、膠原病の一つである全身性エリテマトーデスなどの発症につながることなども明らかにしています。
岩井氏の直鎖状ポリユビキチン鎖・LUBACをめぐる一連の研究成果は、ユビキチン鎖の構造的ならびに機能的な多様性を研究者たちに強く認知させるものと世界的に評価されています。