LF対談
piRNAの生合成とトランスポゾン抑制 この二つをテーマに研究を進めています。 No.99(2023.6)

東京大学大学院理学系研究科 生物科学専攻 教授
塩見美喜子 氏
公益財団法人 千里ライフサイエンス振興財団
審良静男 理事長
パートナーとともに留学
研究補佐から研究者へ
審良 今回は塩見美喜子先生をお迎えしました。優れた研究業績に惹かれたのはもちろんですが、先生の生き方や考え方が研究者をめざす女性のみなさんにも大いに参考になるのではないかと思っています。
塩見 よろしくお願いします。
審良 塩見先生は岐阜大学の農学部農芸化学科に入られました。どのようなことでこの学部学科に行かれたのですか。
塩見 理系の学部に入ることは考えていて、父が一級建築士だったので「建築学科もいいな」とも思っていました。高校の先生と相談したり、自分の成績を考慮したりして、岐阜大学農学部を受験することにしました。
審良 その後、京都大学大学院の農学研究科に進み修士課程で遺伝子工学を研究されたと聞きます。どんな大学院生でしたか。
塩見 振り返ってみると、普通の大学院生でしたね。成績は良くも悪くもなく……。
審良 研究者としてやっていこうというきっかけは、なにかあったのですか。
塩見 修士課程を修了してから主人(春彦氏、現・慶應義塾大学医学部分子生物学教室教授)と結婚し、米国の留学先にいっしょに付いていったことですね。私が修士課程を修了するとき、彼は京都大学のウイルス研究所(現ウイルス・再生医科学研究所)で博士号を取ったところでして、海外留学を望んでいました。
私は「海外を経験するのは自分にもよいこと」と思い、彼に付いていったのです。ペンシルバニア大学ハワードヒューズ医学研究所のギデオン・ドレイファス研究室で、私は研究補佐役として、彼はポスドクとして過ごしました。その後、私は博士研究員となりました。
審良 そのときの塩見先生の博士論文のテーマは「脆弱X症候群遺伝子の機能解析」といったものだったとお聞きします。脆弱X症候群とはどういった病気でしょうか。
塩見 遺伝病の一つで、3塩基繰り返し配列の異常伸長により引き起こされるトリプレットリピート病として最初に見つかった病気です。脆弱X症候群では、frm1という遺伝子での繰り返し配列が、健常人で数十程度ですが、患者の方では代々長くなっていきます。長くなると転写が起こらなくなり、精神遅滞などさまざまな症状を伴うようになります。博士号取得以降も脆弱X症候群の原因遺伝子であるfmr1の機能解析を研究しました。
PIWI-piRNA複合体
トランスポゾン抑制機序を解明
審良 脆弱X症候群の原因遺伝子の研究を続けたとのことですが、その後、塩見先生は小分子RNAの研究に進まれていかれたものと思います。小分子RNAは1990年代、線虫からマイクロRNA(miRNA)として発見され、2000年代に急速に研究が発展してましたね。小分子RNAにはほかに、短鎖干渉RNA(siRNA)もよく知られていて、メッセンジャーRNAの破壊によって遺伝子発現を抑制するRNA干渉(RNAi)とよばれる現象を引き起こすといいます。RNA干渉は2006年にノーベル生理学・医学賞を受賞したアンドリュー・ファイアーとクレイグ・メローの研究対象でもあります。塩見先生におかれては、脆弱X症候群から小分子RNAの研究へと、どうつながっていったのでしょう。
塩見 帰国して1999年から所属した徳島大学のゲノム機能研究センターでの研究に、脆弱X症候群から小分子RNAにつながっていくきっかけがありました。主人とともに研究室を運営することになったのですが、私はひきつづき脆弱X症候群の研究をしようと考えていました。ただし、ペンシルベニア大学時代と同様に哺乳動物を使って研究すると、ボスのドレイファス先生と競合してしまいます。そこで、哺乳動物でなくショウジョウバエを使って脆弱X症候群の研究をすることにしたのです。ショウジョウバエも下等動物ながら、脆弱X症候群の原因遺伝子であるfmr1をもっていることが知られていました。
審良 ハエもfmr1遺伝子に異常があると、精神遅滞になるのですか。
塩見 それもあるかもしれませんが、frm1遺伝子をノックアウトしたショウジョウバエを見ると、体内時計により支配される概日リズムが乱れることがわかりました。人の脆弱X症候群の方にも睡眠異常や体内時計の乱れが見られることがあります。
それで、ここから小分子RNAの研究につながってくるのですが、fmr1遺伝子がつくりだすFMRPタンパク質を生化学的に解析したところ、FMRPタンパク質が、小分子RNAの作用のひとつであるRNA干渉の中核因子Ago2と特異的に相互作用することを見出したのです。つまり、FMRP-Ago2という相互作用を見出せたことで、脆弱X症候群とRNA干渉の接点を得られたわけです。当時、RNA干渉の研究が流行気味だったこともあり、研究成果はメディアでも取り上げられました。それで、私もRNA干渉について調べてみたところ、まだ分子メカニズムについてはあまりわかっていないようでした。「であれば、いっそのことRNA干渉の研究にシフトしてみよう」と考え、RNA干渉の研究に移っていったのです。
審良 そうでしたか。けれども、RNA干渉やsiRNAの研究は、いまの塩見先生の代名詞といえるpiRNAの研究とは異なりますよね。その後どのようにpiRNAに行きついたのでしょうか。
塩見 まだ未開領域だったpiRNAに興味を抱くようになり、そちらに移っていったのです。piRNAは、小分子RNAのなかでも生殖組織に特異的に発現します。全身に関わるmiRNAやsiRNAの研究はさかんにおこなわれていましたが、卵巣や精巣を必要とする小分子RNAの研究はさほどおこなわれていませんでした。
たしかに、私も小分子RNA研究を始めたときは、siRNAやRNA干渉に興味をもって全身性のAgo2を研究していたわけですが、「待てよ。生殖組織特異的な小分子RNAの研究はまだ手つかず状態だ」と、興味が向いていったのです。
審良 なるほど。
塩見 それで、卵巣あるいは精巣から関連しそうなタンパク質を取ってきて、そのタンパク質と結合している小分子RNAもあわせて解析してみました。それまで私は卵巣・精巣における小分子RNAは「miRNAだろう」と思っていたのですが、タンパク質と結合していたのはmiRNAでなくpiRNAだったのです。PIWIというタンパク質とpiRNAが結合して複合体を形成していたことを見出しました。
しかも、おもしろいことにPIWIとpiRNAの複合体がなにを標的にしているかというと、トランスポゾンだったのです。実験で、PIWIをなくしてしまったり、piRNAの生合成経路を欠損させたりして、PIWIとpiRNAの複合体がはたらかないようにすると、逆にトランスポゾンの発現が異常なほどに上昇します。
審良 PIWIとpiRNAの複合体が生殖組織特異的にトランスポゾンの発現を抑制していたわけですか。そもそもトランスポゾンは「動く遺伝子」ともいわれ、割合としてヒトゲノムのじつに40%以上をトランスポゾンかその残骸が占めているといいますね。
塩見 ええ。トランスポゾンは、ウイルス由来の外来性核酸因子です。「動く遺伝子」とおっしゃいましたが、まさにそうで、ウイルスみたいに適当に動きまわるのです。
審良 「動く遺伝子」をヒトを含め多くの生物がもっているわけですか。バーバラ・マクリントックは、トウモロコシを研究材料にしているなかトランスポゾンを発見し、ノーベル生理学・医学を受賞しましたね。
塩見 ええ、ヒトもトウモロコシも、トランスポゾンをもっています。大腸菌ももっています。
審良 トランスポゾンはどういう役割をしているのですか。
塩見 簡単にいうと、悪さもしますし、それでもなお私たちがもちつづけているということは良いこともしているはずです。
審良 進化にも関わっているといわれていますよね。
塩見 ええ。たとえば、東京医科歯科大学の石野史敏先生は、ある種のトランスポゾン由来の遺伝子は、胎盤の初期形成の段階で必須なはたらきを担っていたと発表されています。
審良 僕らの免疫学の分野では、遺伝子の相同組み換えで触媒作用を及ぼすある種のリコンビナーゼの進化は、もともと体に入り込んだトランスポゾンによるものではないかという話を聞いたりもします。塩見先生が着目された生殖組織でトランスポゾンは役割をもっているのですか。
塩見 はい。悪さをします。
審良 悪さ! 生殖組織でトランスポゾンの発現があると生殖に悪いことが起きると……。
塩見 そうです。トランスポゾンが卵子や精子のなかで動きまわって発現すると、生殖組織をボロボロに傷つけます。傷ついてしまった生殖組織は、次世代を残すことができません。ですので、PIWIとpiRNAの複合体が生殖組織におけるトランスポゾンの発現を抑えているのです。
審良 哺乳動物などでpiRNAのはたらきがなくなると……。
塩見 不妊になります。
piRNAそのもの以外にも
研究の視線を向けている
審良 ご研究をどう進めてこられましたか。徳島大学から慶應義塾大学、さらにはいまおられる東京大学へと移られたわけですが。
塩見 ひきつづきPIWIタンパク質とpiRNAを研究対象にしています。私が常に知りたいのは二つのこと。つまり、どのように小さなRNAであるpiRNAが生合成されるかと、どのようにpiRNAがトランスポゾンの発現を抑制するかです。
審良 直近ではどんな成果を得ましたか。
塩見 まず、piRNAの生合成については、いま多くの生命科学の研究者が注目している「液-液相分離」が関与していることがわかってきました。piRNA前駆体が核で作られたのちに細胞質へと移行してpiRNAへの生合成が始まるのですが、その反応場は液-液相分離により形づくられていたのです。どのようにpiRNAの形成が促されているのかをさらに見ているところです。
もう一つ、piRNAの生合成関連でいうと、生殖細胞内のpiRNA増幅機構の制御にがん抑制因子が関与していることがわかってきました。すこし詳しく話すと、卵巣には生殖細胞と体細胞の二つの細胞があります。生殖細胞のほうが体細胞よりも複雑で、つくったpiRNAを増幅させるのです。研究で生殖組織を用いて解析しようとするうえで、生殖細胞と体細胞が混じった状態はノイズになりうるため、生殖細胞のみを培養することはできないか考えていました。さまざまな研究者の論文を読むなかで、ショウジョウバエのがん抑制因子であるL(3)mbtに行きついたのです。卵巣由来の体細胞に対してL(3)mbtを発現させないようにしたところ、元々piRNA増幅機構を持たない体細胞にその仕組みを持たせることができたのです。piRNAの増幅には一つや二つでなく10以上の遺伝子が関与しているのですが、がん抑制因子のL(3)mbtは、それらの遺伝子の発現を一斉に抑え込んでいるようです。興味深くこの解析もおこなっています。これまではpiRNAそのものに目を向けて研究していましたが、L(3)mbtのような抑制因子がもつシステムの制御のしくみに目を向けているところです。
それに、トランスポゾンによる宿主ゲノム変異と進化というテーマにも目を向け、自由に動きまわる遺伝子であるトランスポゾンが保存されていることの宿主にとっての利点はなんなのかを探っています。たとえば、トランスポゾンが、タンパク質の基本的機能はおなじながら構造の一部が異なるアイソフォームを特異的につくりだしていることがわかってきました。

塩見美喜子 氏
東京大学大学院理学系研究科 生物科学専攻 教授
1962年、愛知県生まれ。84年岐阜大学農学部を卒業。88年京都大学大学院農学研究科修士課程修了。90年ペンシルバニア大学ハワードヒューズ医学研究所のGideon Dreyfuss博士の研究室にて研究補佐。94年京都大学にて博士号(農学)取得。97年JST若手研究者長期在外研究員、99年ペンシルバニア大学医学部生物物理学科研究員。99年徳島大学ゲノム機能研究センター助手。2003年徳島大学にて博士号(医学)取得。同センターで講師、助教授、准教授をつとめる。08年慶應義塾大学医学部大学院医学研究科総合医科学研究センター准教授。09年同大学医学部分子生物学教室准教授。12年東京大学大学院理学系研究科生物化学専攻(14年4月より生物科学専攻に改名)教授、現在に至る。専門分野はRNA生物学。RNAサイレンシング作用機序の研究などをおこなう。おもな受賞歴は、康楽賞、猿橋賞。日本分子生物学会、日本RNA学会、RNA Society各会員。18年よりEMBO Associate Member。趣味は、トレッキング、ウォーキングなど。
女性研究者増に重要な
母親の理解とモデルの存在
審良 塩見先生は自然科学分野で顕著な研究業績を収めた女性科学者に贈られる「猿橋賞」の受賞者でもあります。ここからは、日本の女性研究者の活躍についてお話を聞ければと思っています。
私が所属している大阪大学免疫学フロンティア研究センターは、毎年ドイツのボン大学と共催で免疫学のインターナショナルスクールを行っています。直近では世界の若手研究者400人ほどの参加応募を受け、約50人を選びましたが6割が女性になりました。
塩見 それはすごいですね。
審良 海外の学会などに行くと、とくに免疫学の分野では、登壇者の半分ぐらいは女性という印象ですし、聴衆も女性がとても多い。一方で日本で女性研究者の数が増えていないと感じます。塩見先生はどんなところに原因があると思われますか。
塩見 私の家でもよく話題にしていますが、突き詰めると母親の影響があるのではないかと思います。以前『LFニュース』の対談記事で、稲葉カヨ先生(京都大学副学長〈2015年当時〉)が、母親が文系出身の家族が多い状況で女の子が理系に進む可能性は低いと思うとおっしゃっていましたね。わが娘が理系という自分の知らない世界に進むことに抵抗感があり、それが伝わって子どもが理系を選ばないのではないのではないかと思います。
審良 そうですか。僕らが若かった時代にくらべたら、女性でも理系・文系の分け隔てはなくなってきている感はありますが。
塩見 もちろん、理系に進む女性は増えてきてはいると思います。けれども状況を見ていると、女子学生は修士課程を修了したあと企業就職することが多く、博士課程に進んで学術の世界にいつづけることは多くありません。わが娘に「博士号なんてとってどうするの」とおっしゃる母親はいまもいる様です。
審良 いま日本の大学は、女性の教授の比率を意識的に増やそうとしている時期なので、研究者になりたい女性の方々にとってはよい時期である気もするのですが……。
塩見 おっしゃるとおり、女性限定の採用の公募などは見かけますね。けれども、よく見ていると、Aという組織に所属する女性教授をBという組織に移すだけということも多く起きています。これだと、動きはあれど数は増えません。「10年後に女性教授の比率を30%にしましょう」といった目標には到達しないと思います。もっと、下からボトムアップをしないと……。
審良 ボトムアップのためにはどうしたらいいでしょうか。
塩見 女子高校生あたりの年代をねらっていかなければならないと思います。そのためには、やはり母親たちに理系進学への理解をしてもらうことも大切になります。東京工業大学が2024年4月入学の学士課程入試から「女子枠」を導入すると聞きます。そうした取り組みは良いことだと思っています。重要なのは、そうした学生たちに博士課程まで進んでもらうことです。
審良 女性の研究者に「かっこいい」という印象も抱きます。人びとの前で自分の研究についてプレゼンテーションをして、みんなから拍手を受けるようなことに、「自分もああいう人になりたい」と感じてくれる人が出てきてくれればと思うのですが。
塩見 身近にロールモデルがいるということは必要だと思いますね。留学先の研究室にいた妊婦や母親の研究者は、当時の私にとってロールモデルでした。留学の最後の4年間、私も含めほぼいつも妊婦がいるような状況でした。「先輩」たちのやり方を見れば、どのくらいのタイミングで出産休暇をとり復帰するかや、どのように保育所に子どもを預けるかといったことはわかります。それに、パートナーの男性は6時から15時までの勤務とし、女性は12時から21時まで勤務するといったように夫婦で勤務時間のやりくりをしていました。これにより、ベビーシッターに頼る時間帯も短くなり経済的にも楽になります。不安なく出産も育児も研究もできたのは、とても良かったと思っています。
日本でも、こうしたことを実践する研究者が増えていくことが大切だと思います。
審良 今日は参考になるお話をいただき、どうもありがとうございました。
(対談日/2023年2月21日)
EYES
小さなRNAとアルゴノートタンパク質による 遺伝子の発現抑制
RNAサイレンシングのしくみを解明
トランスポゾン抑制により生殖能を守る
「piRNA機構」に光を当てる
RNAには、タンパク質合成の遺伝情報を写 RNAには、タンパク質合成の遺伝情報を写しとって伝えるmRNA(messenger RNA)や、タンパク質の合成に直接関与するtRNA(transfer RNA)などよりも塩基配列の短い、約20~30塩基からなる「小分子RNA」があります。小さな身である小分子RNAには、遺伝子の発現を抑制するという生命にとって大きなはたらきを担うことがあります。このはたらきを「RNAサイレンシング」といいます。具体的には、小分子RNAがアルゴノートとよばれるタンパク質と結合し、RISC(RNA-Induced Silencing Complex)という複合体を形成したうえで、小分子RNAが標的のRNAに結合し、それをアルゴノートが切断して消滅させるのです。
小分子RNAはあまりに小さいことから、かつて細胞内の不用物のように考えられていました。しかし、その後の研究で、小分子RNAは、mRNAの転写や翻訳を妨げることで、あるいは、先に示したようにアルゴノートが持つRNA切断能の助けを借りて、特定の遺伝子の発現を抑えるということがわかってきたのです。
RNAサイレンシングを担う小分子RNAには、次のようなものがあることが知られています。
まず、短鎖干渉RNA(siRNA:small interfering RNA)です。RISCとしてmRNAに対合し、RISCのタンパク質を介してmRNAを切断し、遺伝子的なはたらきを抑えます。この作用はRNA干渉(RNAi:RNA interference)ともよばれます。
つぎに、マイクロRNA(miRNA:microRNA)です。mRNAが翻訳の鋳型となるのを妨げたり、mRNAのポリA鎖とよばれる部分を短くしてmRNAを不安定化させたりして、mRNAのはたらきを抑えます。
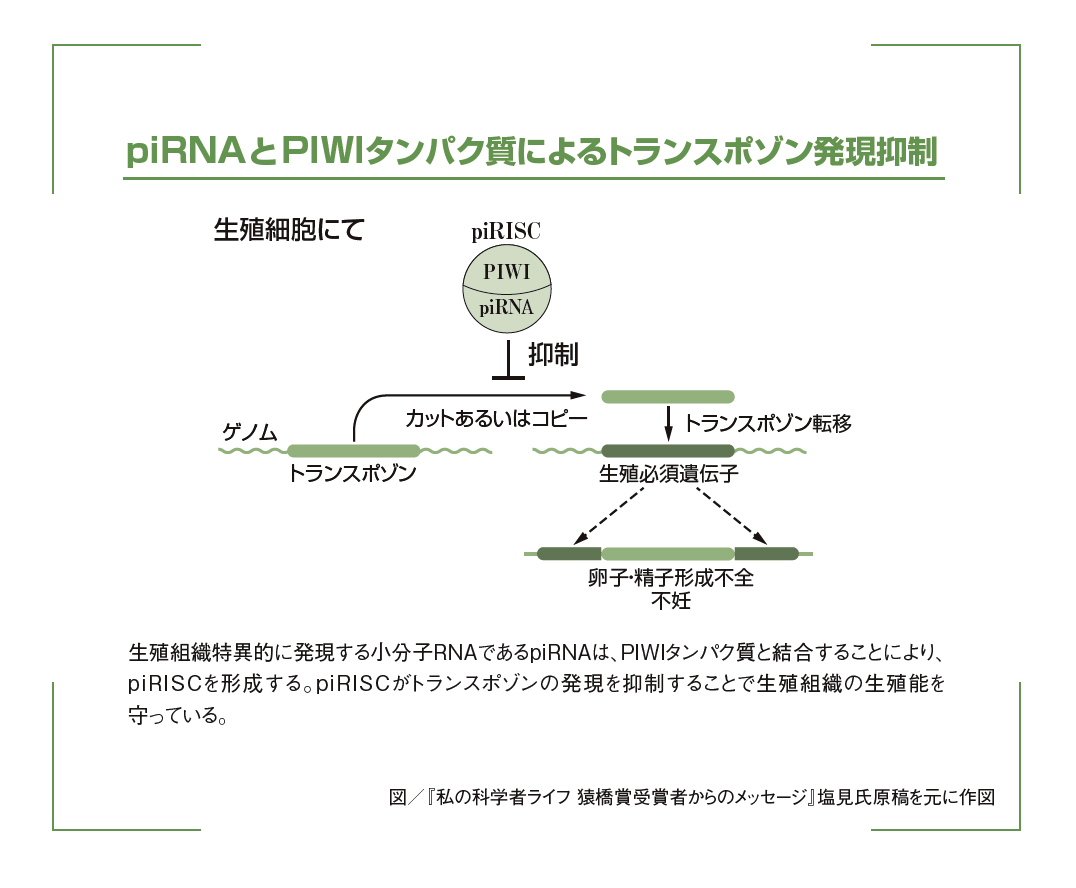
そして、PIWI相互作用RNA(piRNA:PIWI-interacting RNA)です。piRNAは卵巣や精巣などの生殖組織特異的に発現し、かつ染色体上を移動することのできる“動く遺伝子”トランスポゾンを標的にその発現を抑えます。トランスポゾンはもともと外来性のウイルス遺伝子のようなDNA断片であり、自身を「宿主」のゲノムから切り出す(カット・アンド・ペースト)か、自身を複製(コピー・アンド・ペースト)することで、宿主のゲノムに割って入ります。トランスポゾンはときに利益をもたらす一方で、生殖組織においては生殖に必須の遺伝子を破壊するおそれがあるため、防御的にはたらくpiRNAの存在はとても重要といえます。
対談記事に登場する塩見美喜子氏は、RNAサイレンシングの作用メカニズムを分子レベルで解明してきました。まず、RNA干渉に関連して、当初、塩見氏が研究していた「脆弱X症候群」という遺伝病の原因遺伝子fmr1がつくりだすFMRPタンパク質が、RNA干渉の中核因子Ago2と特異的に相互作用することを発見しました。この研究成果は、遺伝疾患とRNA干渉との接点を見出したものとして高い評価を受けるものとなりました。
塩見氏はさらに、piRNAのはたらきに興味をもち、モデル動物のショウジョウバエを対象に研究を進めます。piRNAが、卵巣や精巣などの生殖組織に特異的にアルゴノートタンパク質群に属するPIWIと結合してRISCを形成すること、また、このRISCがトランスポゾンの発現を抑えることで不稔を防ぎ生殖組織の機能が保たれること、さらにPAPIおよびZucchiniとよばれる生合成因子がpiRNAの生合成の機能を担っていることなどを見出してきました。トランスポゾンが生殖組織内を「動く」ことを起因とした生殖ゲノムの損傷を回避するという、生命の生殖にとって重要なメカニズムの解明を進めてきたわけです。
いまなおpiRNA機構の作用メカニズムの完全な理解には至っていないとも塩見氏は述べます。引き続き、ショウジョウバエやカイコをモデル生物とし、生化学的・細胞生物学的解析や生物情報解析を駆使して、作用メカニズムを解明することを目指しています。RNAサイレンシング研究の地平がさらに広がっていくことが期待できます。
塩見氏は、自然科学分野で顕著な研究業績を収めた女性研究者を対象に表彰する「猿橋賞」を受賞するなど、女性の研究者のロールモデルとしても評価されています。対談では、RNAサイレンシング研究の成果とともに、女性研究者の活躍に向けた課題についても語られています。ぜひご覧ください。しとって伝えるmRNA(messenger RNA)や、タンパク質の合成に直接関与するtRNA(transfer RNA)などよりも塩基配列の短い、約20~30塩基からなる「小分子RNA」があります。小さな身である小分子RNAには、遺伝子の発現を抑制するという生命にとって大きなはたらきを担うことがあります。このはたらきを「RNAサイレンシング」といいます。具体的には、小分子RNAがアルゴノートとよばれるタンパク質と結合し、RISC(RNA-Induced Silencing Complex)という複合体を形成したうえで、小分子RNAが標的のRNAに結合し、それをアルゴノートが切断して消滅させるのです。
小分子RNAはあまりに小さいことから、かつて細胞内の不用物のように考えられていました。しかし、その後の研究で、小分子RNAは、mRNAの転写や翻訳を妨げることで、あるいは、先に示したようにアルゴノートが持つRNA切断能の助けを借りて、特定の遺伝子の発現を抑えるということがわかってきたのです。
RNAサイレンシングを担う小分子RNAには、次のようなものがあることが知られています。
まず、短鎖干渉RNA(siRNA:small interfering RNA)です。RISCとしてmRNAに対合し、RISCのタンパク質を介してmRNAを切断し、遺伝子的なはたらきを抑えます。この作用はRNA干渉(RNAi:RNA interference)ともよばれます。
つぎに、マイクロRNA(miRNA:microRNA)です。mRNAが翻訳の鋳型となるのを妨げたり、mRNAのポリA鎖とよばれる部分を短くしてmRNAを不安定化させたりして、mRNAのはたらきを抑えます。
そして、PIWI相互作用RNA(piRNA:PIWI-interacting RNA)です。piRNAは卵巣や精巣などの生殖組織特異的に発現し、かつ染色体上を移動することのできる“動く遺伝子”トランスポゾンを標的にその発現を抑えます。トランスポゾンはもともと外来性のウイルス遺伝子のようなDNA断片であり、自身を「宿主」のゲノムから切り出す(カット・アンド・ペースト)か、自身を複製(コピー・アンド・ペースト)することで、宿主のゲノムに割って入ります。トランスポゾンはときに利益をもたらす一方で、生殖組織においては生殖に必須の遺伝子を破壊するおそれがあるため、防御的にはたらくpiRNAの存在はとても重要といえます。
対談記事に登場する塩見美喜子氏は、RNAサイレンシングの作用メカニズムを分子レベルで解明してきました。まず、RNA干渉に関連して、当初、塩見氏が研究していた「脆弱X症候群」という遺伝病の原因遺伝子fmr1がつくりだすFMRPタンパク質が、RNA干渉の中核因子Ago2と特異的に相互作用することを発見しました。この研究成果は、遺伝疾患とRNA干渉との接点を見出したものとして高い評価を受けるものとなりました。
塩見氏はさらに、piRNAのはたらきに興味をもち、モデル動物のショウジョウバエを対象に研究を進めます。piRNAが、卵巣や精巣などの生殖組織に特異的にアルゴノートタンパク質群に属するPIWIと結合してRISCを形成すること、また、このRISCがトランスポゾンの発現を抑えることで不稔を防ぎ生殖組織の機能が保たれること、さらにPAPIおよびZucchiniとよばれる生合成因子がpiRNAの生合成の機能を担っていることなどを見出してきました。トランスポゾンが生殖組織内を「動く」ことを起因とした生殖ゲノムの損傷を回避するという、生命の生殖にとって重要なメカニズムの解明を進めてきたわけです。
いまなおpiRNA機構の作用メカニズムの完全な理解には至っていないとも塩見氏は述べます。引き続き、ショウジョウバエやカイコをモデル生物とし、生化学的・細胞生物学的解析や生物情報解析を駆使して、作用メカニズムを解明することを目指しています。RNAサイレンシング研究の地平がさらに広がっていくことが期待できます。
塩見氏は、自然科学分野で顕著な研究業績を収めた女性研究者を対象に表彰する「猿橋賞」を受賞するなど、女性の研究者のロールモデルとしても評価されています。対談では、RNAサイレンシング研究の成果とともに、女性研究者の活躍に向けた課題についても語られています。