LF対談
本当に自分しかできない研究を見つけないと、これからはむずかしいと思います。 No.97(2022.10)

公益財団法人 千里ライフサイエンス振興財団
審良静男 理事長
公益財団法人 千里ライフサイエンス振興財団
岸本忠三 名誉理事長
岸本研究室の配属初日に
本庶研究室へ“留学”
岸本 『LFニュース』で僕がホストをつとめる対談は今回が最後となります。直近では、数学の森重文先生(第95号)や、歌人でもおられる永田和宏先生(第94号)ともお話しましたが、前もって勉強する必要がありました。今回お迎えしたのは、かつて僕の研究室に所属していた審良静男先生。勉強しなくてもお話しできます(笑)。審良先生は僕の後任で千里ライフサイエンス振興財団の理事長にも就かれるので、そのことについてもお話ししたいと思います。
審良 どうぞよろしくお願いします。
岸本 僕の研究室にまず入ってこられたときのころから話を始めましょうか。
審良 1980年の4月でしたね。大学院生として岸本先生の研究室に入りました。
岸本 僕の研究室に入ったけれど、僕は審良先生に遺伝子や分子生物学のことを深く学んでほしいと思って、「本庶佑先生の研究室に行ってこい」って言ったんでした。
審良 はい。私は岸本先生が取り組んでおられたT細胞とB細胞の相互作用について研究したいと思っていたのですが、研究室に入った初日に岸本先生に連れられて、本庶先生の研究室に向かったのでした。
岸本 連絡橋を渡って行きましたね。後日、審良先生は「橋を渡ったらちがった世界があった」って言っておられた(笑)。そこから審良先生の研究は始まったわけですね。
審良 そう思います。本庶研究室で得た分子生物学の知識を生かすかたちで、その後、免疫学に戻ってくることができました。
岸本 それで2年後、僕の研究室に戻ってこられました。
審良 ええ。岸本先生の下に戻ってきてからは、本庶研究室での研究と関連して、VDJ遺伝子再構成についての研究をしました。その後、カリフォルニア大学バークレー校におられた坂野仁先生の研究室に所属したわけですが、そこでもVDJ遺伝子再構成に関わる酵素について研究しました。
岸本 それで、帰国されてから大阪大学の細胞工学センターで、インターロイキン6(IL6)関連の研究をされたわけですね。
審良 そうです。まず、IL6のプロモーター領域に結合する因子としてNF-IL6を、それから、IL6のシグナル伝達に関わる因子としてSTAT3をクローニングしました。
岸本 STAT3の研究では、たくさんのマウスにIL6を注射して、肝臓からSTAT3を精製したと聞きます。それで業者から「もうマウスありません」と言われたって有名な逸話がありますね(笑)。
審良 大量のマウスを使うこともあり、実験で役目を果たしたリタイアマウスを使っていたのですが、それが枯渇したというのが事実なんですよ(笑)。東レがIL6を提供してくださいました。
岸本 それで、僕がハワイの学会に出席したとき、海外のグループがSTAT3についての論文を『Science』に出す予定というのを聞きつけて、審良先生に「早く出さないと」と電話したんでしたね。
審良 はい。私は大慌てで『Cell』に投稿しましたが、編集部に別グループが『Science』に投稿していると伝えると、すぐレビューに回してくれて、ほぼ同時に掲載となりました。
岸本 それが出世作の始まりですね(笑)。
「ゼロから新しいことに挑もう」
Toll様受容体の研究へ
岸本 その後、審良先生は研究で、免疫系のなかでも自然免疫のはたらきの重要性を見出すことになりました。どういう経緯で自然免疫の研究に進んだのですか。
審良 1996年、兵庫医科大学の教授になったのですが、「もとの研究室でやっていた研究はしない。ゼロから新しいことに挑もう」と思っていたのです。
岸本 とても大事なことだと思います。
審良 それまでの研究はその研究室にいたからできたのであり、独立して自分の研究をすることこそ自分の力を発揮することだと前から思っていたんです。それに自分の分野もつくりたかった。とはいえ、いきなり自分の分野をつくるのはむずかしいので、岸本先生の研究室でやっていたノックアウトマウスを使って研究テーマを探そうとしたんです。それが自然免疫の分野に進んだ経緯になりますね。
岸本 そうですか。それで、どんなことから始めたのですか。
審良 骨髄性白血病細胞をIL6で刺激するとマクロファージに分化するのですが、STAT3のはたらきを阻害するとマクロファージに分化しなくなることがわかっていました。下流の因子がなんらかの形でマクロファージへの分化を制御しているのではないかと。それで当時、ミエロイド系分化因子(MyD)というのがいくつも報告されていて、「MyDのうちの一つが関わっているのではないか」と考え、すべてのMyDをノックアウトしていきました。MyD88をノックアウトしたマウスでは、マクロファージに正常に分化したのですが、その後、IL1というサイトカインの受容体が見つかり、MyD88ノックアウトマウスを使って、IL1の反応を見てみると、反応しませんでした。つまり、MyD88はIL1のシグナル伝達分子だとわかりました。
それは一件落着したわけですが、たまたま学生がMyD88ノックアウトマウスにリポ多糖(LPS)という菌体内毒素を注射したところ、マウスがまったく死ななくなったんです。おもしろい現象だと思い、IL1ファミリーの受容体をすべてノックアウトしてLPSの反応性を調べたのですがなにも変わりません。そのころ、米国の研究グループが、Toll様受容体(TLR)というものがあってIL1受容体に似ていると報告したのです。私たちはそれまで、IL1を追いかけていたけれど、じつはMyD88はTLRの下流にあるのではと考えるようになり、今度はTLRファミリーをすべてノックアウトしていきました。すると、TLR-4ノックアウトマウスがLPSに反応しないことがわかったのです。つまり、LPSを認識する受容体はTLR-4だとわかりました。この成果を論文投稿し、1999年4月に発表したのですが、米国のグループは1998年12月でした。「1年」の差がついてしまったのです。
岸本 それがノーベル賞になるかならないかにつながったのですね。TLRは12番まであると聞きます。審良先生たちがすべて単離したのですか。
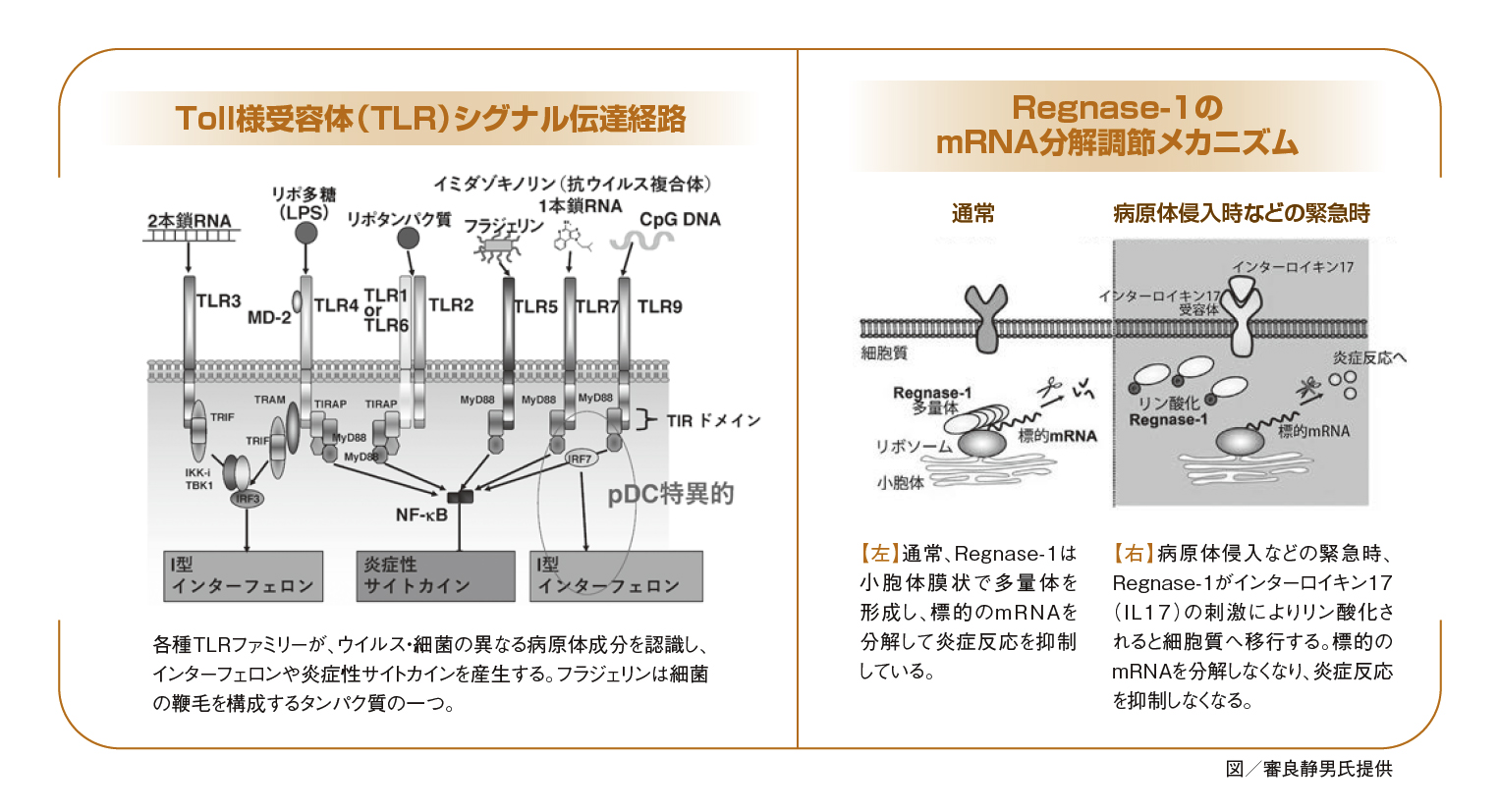
審良 ノックアウトはすべて私たちでおこないました。それで、各TLRがどういうものを認識しているかをほぼすべて決定することができました(下図参照)。
岸本 それぞれのTLRがどういったものを認識しているかがわかり、それが自然免疫についての発見につながるわけですか。
審良 たとえば、TLR-9が、病原体に特異的なCpG DNAというDNAを認識することがわかりました。またマクロファージが病原体を消化するとき、その病原体のDNAを検知することもわかってきました。同様にTLRファミリーそれぞれが異なる病原体の成分を認識しているのです。自然免疫は非特異的な反応ではなかったわけです。
さらに、TLR-7を通じてウイルスのRNAが自然免疫を活性化し、それにより獲得免疫が活性化することも解明しました。
岸本 TLR-7はRNAを認識しているわけですよね。RNAを制御するような薬はできないのですか。新型コロナウイルス(SARS-CoV-2)のmRNAワクチンはカタリン・カリコさんたちが実現させたけれど。
審良 病原体のRNAは結構、炎症を引き起こします。以前、カリコさんが共同研究を提案してきて、2008年に「シュードウリジンをmRNAに組み込むと、翻訳能力と生物学的安定性に優れた非免疫原性発現ベクターが得られる」という論文を共同で出したことがあります。当時はカリコさんの成果の意味がわからなかったけれど、いま思えばmRNAワクチン開発につながったのだなと。
Regnase-1の炎症制御の
はたらきを解明
岸本 その後、審良先生の研究はどう進んでいったのですか。
審良 TLRファミリーのリガンドについては、先ほど言いましたようにほぼすべて私たちで解明し、TLRシグナル伝達系もほぼすべて私たちで把握することができました。その後、TLR経路の活性化の結果として発現誘導される遺伝子の解析に興味をもち、TLRの誘導遺伝子群をまたすべてノックアウトし、それぞれの反応を見ていったのです。すると、たまたまRegnase-1というTLR誘導遺伝子に行き当たりました。これが興味深くて、発現をノックアウトするとマウス全身に炎症が起きるのです。
さらに探っていくと、Regnase-1がIL6などの炎症性サイトカインの遺伝子mRNAの不安定化を制御して、炎症性疾患の発症を抑制していることがわかってきたのです。私はかつて研究で、IL6のシグナル伝達に関わる分子としてSTAT3をクローニングしたといいましたが、Regnase-1でふたたびIL6に戻ってくることになりました。不思議なもので、岸本先生の研究されていたIL6からは離れられないみたいです(笑)。
岸本 やっぱり審良先生は、IL6に戻ってくるのですね(笑)。Regnase-1は、mRNAの不安定化を制御するわけですか。
審良 ええ。IL6の非翻訳領域とよばれるところに付いて、IL6などのサイトカインの遺伝子mRNAを分解します。絶えず分解することで、炎症を抑えているのです。
岸本 Regnase-1のはたらきをなくしたら、病気になってしまうわけですね。
審良 そうです。体のなかでさまざまな症状が起きますが、もっとも重大なのはプラズマサイトーシスという炎症性疾患です。体内の組織全体にB細胞のもっとも成熟した段階であるプラズマ細胞が集まって炎症を呈します。
岸本 となると、Regnase-1のはたらきを保つものをつくれば薬になるわけですか。
審良 そうです。Regnase-1の安定化がなにより重要です。実際、Regnase-1がなくならないようにする抗炎症剤の開発を製薬企業はめざしています。
岸本 だけれど、Regnase-1はどうやってサイトカインの遺伝子mRNAの不安定化を制御しているんですか。
審良 Regnase-1のある特定の部分にリン酸化が起きると、Regnase-1が分解されます。ですので、Regnase-1の特定の部分に結合し、リン酸化酵素を結合できなくする化合物ができればよいわけです。むずかしいですが、そういう方向で進んでいます。
Regnase-1の代謝への影響や
マクロファージの肺線維症関与を研究中
岸本 審良先生はおいくつになりましたか。
審良 69歳です。
岸本 阪大の教員としての定年から5年弱ですか。いまもなお阪大で免疫学フロンティア研究センター(IFReC)の特任教授でおられるということは、研究をさらに進めているということですか。
審良 はい。まず、Regnase-1の研究をさらに進めています。これまで炎症の観点からRegnase-1を見てきましたが、Regnase-1は代謝に対しても影響があることがわかってきました。Regnase-1は進化の過程でよく保存されていて、線虫のC.elegansにも存在しますが、そこでは脂肪細胞を貯める役割をしているのです。Regnase-1をなくすと脂肪のない線虫ができます。
岸本 マウスではどうなのですか。
審良 じつは、非アルコール性脂肪肝炎(NASH)との関連が見えてきました。マウスの実験では、肝臓特異的にRegnase-1のないマウスを使うと、NASHに対して抵抗性を呈することがわかってきました。いまはそのメカニズムを研究しているところです。
岸本 そうですか。Regnase-1以外の研究もされていますか。
審良 肺線維症についての研究にも取り組んでいます。どういうマクロファージが、肺線維化に関わるのかを調べているところです。何年か前にSatMという新規細胞を見つけたのですが、それがなくなるとマウスの肺線維症がまったく起きなくなるのです。IFReCの熊ノ郷淳先生の研究室と連携しながら、ヒトの肺線維症についても見ているところです。

審良静男 理事長
公益財団法人 千里ライフサイエンス振興財団
1953年、大阪府生まれ。77年大阪大学医学部を卒業。78~80年堺市立病院内科医師。84年大阪大学大学院医学系研究科博士課程を修了。以後、日本学術振興会博士研究員、カリフォルニア大学バークレー校博士研究員、大阪大学細胞工学センター免疫研究部門助手、同大学細胞生体工学センター助教授、兵庫医科大学教授を歴任。99年~2018年大阪大学微生物病研究所教授。2007年より大阪大学免疫学フロンティア研究センター拠点長・教授。2018年より大阪大学免疫学フロンティア研究センター特任教授。2022年6月(公財)千里ライフサイエンス振興財団3代目理事長に就任。自然免疫による病原体認識とシグナル伝達の研究を行う。Toll様受容体やRegnase-1の研究は世界的に有名。長らく高被引用論文著者に選出される。おもな受賞歴は、大阪科学賞、高松宮妃癌研究基金学術賞、ロベルト・コッホ賞、紫綬褒章、朝日賞、恩賜賞・学士院賞、米国科学アカデミー会員、文化功労者、慶應医学賞、ガードナー国際賞。日本学士院会員。
いままでとおなじことをしていては
研究の芽は出ない
岸本 審良先生は、論文の被引用件数が多いことでも知られています。論文被引用数で世界一になったこともありましたね。
審良 昔はそうでしたね。
岸本 僕は指数が150ぐらいだったとき、審良先生は100ちょっとぐらいでした。その後、僕は180ぐらいまで行ったけれど、審良先生は200を超えておられた(笑)。まあ、あなたも僕もそうした評価をされたわけです。ところが、近ごろは賞の選考などをしているけれど、日本の研究の質がどうも落ちてきているように感じてならないのです。審良先生はどう思われますか。
審良 そうですね……。なにか一つのことをやり遂げたという研究者はたしかに少なくなってきたでしょうか。「IL6といったら岸本先生」といったような。
岸本 研究の質が落ちたとしたらなんでだろうと考えているのだけれど、研究費が足りないというのは僕はそんなことはないと思っているんです。大規模な予算のプロジェクトもたくさんあるし、大学だってたとえば阪大は2022年に300億円の大学債を発行したりしている。かつては科学研究費で何百万円もらえるかくらいだったわけですし。ならば、任期制が問題かというと、米国の大学を見てもおなじところにずっと居座る人なんてほとんどいません。すると、いったいなにが悪いんだろう、と。
審良 昔より研究することがむずかしくなっているのはあると思います。かつては、なにか一つの分子を見つければ有名になれたものですが、いまはゲノム情報がすべて揃って、さまざまなことが解明されてきました。すると研究も各論に入ってしまうので、よい論文を出すことがむずかしい。
もう一つ、論文1本を書くにも多くのデータが要求される時代になりました。昔はうまく行けば1、2年で論文を出せましたが、いまは5年かかっても発表できないことがあります。学問をすること自体がむずかしくなってきているのではないでしょうか。
逆にいうと、いままでとおなじことをやっていては芽は出ないことになりますね。
岸本 だから、発想の転換が求められる……。
審良 そうですね。みんながやっていて、だれでもできることでなく、本当に自分しかできない研究を見つけていかないと、これからはむずかしいと思います。
岸本 みんな、いまの状況に安住してしまっているような気がします。競争するぞという、燃えるものがないというか……。
審良 自分で新しいものを見つけてやろうというのが、まず研究では必要ですよね。でも、楽しいからということでその研究をやりがちですが、その研究を続けて10年後どうなっているかまで考えてやらなければならないと思うんです。そう学生や研究スタッフたちには言っています。テーマ設定は本当に大事だと思います。
「赤ちょうちん」の継承を
いかに実現していくか
岸本 最後になりますが、このたび千里ライフサイエンス振興財団の理事長を、審良先生にバトンタッチすることになりました。新たに理事長に就任されるにあたり、いまどんな抱負をもっておられますか。
審良 山村雄一先生(千里ライフサイエンス振興財団設立準備委員会会長)がこの財団を築かれ、岡田善雄先生、そして岸本先生が理事長をつとめてこられました。尊敬する先生たちが財団を牽引されてきたと思うと、今回、私がその役割を担えるのはとても光栄なことと思っています。同時に、大きな責任と重圧も感じています。
岸本先生から理事長の職を継ぐのが、ちょうどコロナの時期となりました。いま財団の活動の多くが、オンラインとオンサイトの両方でとなっていますよね。こうした状況で、山村先生が理想とされ、いまも財団の理念となっている「アカデミックな赤ちょうちん」をどうつくっていけるかが課題だと思っています。毎年、元日に山村先生のお宅を訪れ、みんなで「仕事の歌」を歌うという行事がありましたよね。みんなで集まって、話をして盛り上がることがお好きで、おそらく山村先生は、そうしたことを千里ライフサイエンス振興財団の場に求めておられたと思うんです。やっぱり、人と人が会うことで得られるエネルギーみたいなものがあるんじゃないかと思います。これからの時代もそれは大事なことなんだと思っています。
岸本 審良先生は、張り切って千里ライフサイエンス振興財団をリードしてくれるものと思います。ご自身の研究と、財団の運営と、ともに期待しています。
(対談日/2022年6月24日)
EYES
免疫の概念を覆すとともに、
ポスト自然免疫学の新分野を開拓
Toll様受容体のシグナル伝達経路を解明
Regnase-1のmRNA制御のしくみも追究
生体が自己と異なる物質を識別し、排除する現象やしくみを「免疫」といいます。免疫には、生体が生まれながらにもっていて、病原体が感染するとただちに病原体を攻撃する自然免疫と、生後に感染や予防接種などを経て得られ、抗体や特殊なリンパ球の産生を介して病原体を攻撃する獲得免疫があることが知られています。
自然免疫は、とにかくどんな異物が侵入してきてもまずは攻撃をするという、素朴な印象をもたれることがあります。しかし実際のところ、自然免疫は自己と病原体を認識しており、さらに抗体をつくるのに必要といったように獲得免疫のはたらきともつながっているのです。こうした自然免疫のもつ奥深さを、研究により明らかにしたのが、3ページからの対談に登場する審良静男氏です。
審良氏は、ノックアウト(遺伝子欠損)マウスを利用した独自の研究テーマを打ち立てようとするなかで、Toll様受容体(TLR)とよばれる受容体タンパク質に着目します。TLRは、1985年にショウジョウバエの発生における背・腹の軸を決定する遺伝子として発見されたToll遺伝子に似た塩基配列が1997年にマウスで見つかったことから、「Toll遺伝子に類似した受容体」ということで、このよび名となりました。なお「Toll」はドイツ語で「すごい」という意味です。
審良氏は、TLRの12種類の遺伝子を発見し、その一つ一つをノックアウトしたマウスをつくることで、9種類のTLRと、それらの受容体に結合するリガンドを同定しました。さらに、これらの各種TLRに、細菌やウイルスを由来とする、2本鎖RNA、リポ多糖(LPS)、リポタンパク質、フラジェリン、1本鎖RNA、シトシン・グアニン結合配列をもつDNA(CpG DNA)が結合すると、炎症性サイトカインやインターフェロンがつくられ自然免疫がはたらくというTLRシグナル伝達経路を解明しました。これは、非特異的なしくみと考えられていた自然免疫には、異なる病原体の成分を認識するしくみが備わっていることを意味するもので、それまでの自然免疫の素朴な印象を覆す研究成果といえます。
さらに審良氏は、TLRシグナル伝達経路を明らかにするなかで、獲得免疫が効果的にはたらくためには、自然免疫の活性化が必須であることも明らかにしました。たとえば、TLR-7では、ウイルスのRNAがTLR-7を活性化し、この活性化の結果、獲得免疫も活性化するといったメカニズムを解明したのです。自然免疫の存在意義を高める研究成果といえます。
その後、審良氏は、TLRシグナル伝達経路の活性化の結果として発現誘導される遺伝子の機能解析に取り組みました。そして、誘導遺伝子群のうちRegnase-1とよばれる酵素の遺伝子に着目することになります。Regnase-1が、炎症性サイトカインのメッセンジャーRNA(mRNA)を認識・分解することで炎症反応を抑制していることを明らかにしました。Regnase-1は不活性化されると、炎症性サイトカインmRNAは安定化し、炎症反応が誘導されます。Regnase-1のはたらきにより、炎症性サイトカインのmRNAは基本的につねに分解され、病原体侵入などの緊急時にはRegnase-1のはたらきが解かれ、迅速に炎症反応を促進しているわけです。
さらに審良氏は、Regnase-1がTLR、インターロイキン1(IL1)、インターロイキン17(IL17)の刺激によりリン酸化され、このリン酸化がさまざまな炎症反応の制御のために重要な役割を果たしていることなども解明しています。Regnase-1のリン酸化を阻害することが炎症性疾患の増悪を抑制することにつながると考えられ、今後の治療薬の開発にも期待がもたれます。
審良氏のこうした数々の研究成果は、免疫学の分野をはじめとする研究者たちの注目の的となっており、高被引用論文著者としても長らくその名を連ねています。