LF対談
MAPキナーゼが増殖や分化のほか、
発生や寿命にも重要な役割を果たしているとわかってきたのです。 No.101(2024.2)

国立研究開発法人 理化学研究所
生命機能科学研究センター センター長
西田栄介 氏
公益財団法人 千里ライフサイエンス振興財団
審良静男 理事長
物理と生物の間に興味をもち
研究者の道へ
審良 本日はMAPキナーゼの研究者として世界的に知られている西田栄介先生におこしいただきました。先生も私も1953(昭和28)年生まれ。おなじ時代を過ごしてきました。
先生は東京大学に入学され、理学部生物化学科に進まれました。どうしてこの分野を選ばれたのですか。
西田 中学・高校時代の先生の影響が大きいですね。中学のとき担任が物理の先生でして、自然科学への興味が物理をとおしてわいたのです。高校に進むと、今度は生物の先生が当時まだ教科書に載っていなかったDNAの話とかをしてくださいまして。「分子生物学や生化学は、研究すれば世界を開くことのできる、大きな学問分野だ」と思い、研究者になろうと大学に行きました。
理学部生物化学科の4年生のとき、微小管を構成するタンパク質であるチューブリンや、アクチン繊維を形成するアクチンなどを対象に細胞骨格を調べている研究室に入りました。私は物理学に興味をもって生物学に進んだので、生物と物理の間のところに惹かれ、チューブリンの重合メカニズムなどに興味をもちましたね。
審良 大学院に進んでからも、おなじ内容で研究されたのですか。博士論文のテーマは、「微小管再構成の制御」と聞きます。
西田 ええ。ただ、より細胞生物学的な方向に興味が移り、チューブリンやアクチンの重合・集合を制御するタンパク質の因子を、臓器や細胞からとってくるというような研究をしました。チューブリンが微小管になるとき、微小管結合タンパク質(MAPs)がないと重合できないので、これをとってくるわけです。また、アクチンについては、脱重合のための因子をとってきました。「コフィリン」とよばれるもので、私が見つけました。
審良 どんな動物からとってきたのですか。
西田 ブタですね。食肉解体場を訪れ、とれたてのブタの脳をもらって、研究室に帰ってからすり潰してタンパク質をとっていきます。
審良 どれくらいで精製できたのですか。
西田 コフィリンについては「絶対あるだろう」と思いながら実験をつづけ、学位取得後から1年ほどで単離することができて、その性質を解明しました。遺伝子のクローニングは5年ほどあとに共同研究でできました。
MAPキナーゼの発見から
シグナル伝達経路解明まで至る
審良 その後、西田先生が、先生の代名詞といえるMAPキナーゼの研究に至った過程はどういったものでしたか。
西田 他分野と共同研究をするなかで、「受容体に増殖因子などのサイトカインやインスリンなどのホルモンの指令系がくると、受容体が活性してシグナルを細胞核に伝える」という概念を知ったのです。そして、「もしかしたら受容体の下流に共通のシグナル伝達分子のタンパク質キナーゼがあるのかも」と考えるようになりました。
そのとき、先ほど話したチューブリンとの複合体で微小管を構成する微小管結合タンパク質であるMAP2の分子が、タンパク質キナーゼを見つけるのによい基質になるということを実験で確信していました。MAP2の特徴は、分子量が大きく、かつ耐熱性があること。微小管を熱処理するとチューブリンは熱で失活しますが、MAP2は上澄みとして残るので、とても精製しやすいのです。
当時、細胞増殖因子の刺激が細胞膜の受容体を介して細胞核へと伝わり、細胞増殖や分化など細胞運命の決定に至るメカニズムは不明でした。一方で私は、細胞増殖因子は共通して静止期細胞の増殖開始を引き起こす作用をもっているので、その共通の細胞応答を仲介するタンパク質キナーゼが存在するものと考えたのです。
そこで、MAP2をin vitroの基質に用いて、タンパク質キナーゼを探索しました。細胞に対してさまざまな増殖刺激をし、細胞内で活性化するタンパク質キナーゼがあるかどうか調べていくのです。すると、ホルボールエステル(TPA)、上皮成長因子(EGF)、インスリン様成長ホルモン(IGF-1)、線維芽細胞増殖因子(FGF)などでいずれもリン酸化活性が生じました。「やはり、共通に活性化して細胞応答を仲介するタンパク質キナーゼがあるな」と。このキナーゼを当初「MAP2キナーゼ」と命名しました。
審良 さまざまな因子でいずれもリン酸化が強く起きるというのは、ある意味すごいデータとなりましたね。
西田 ええ。ついで、ゲル内キナーゼ検出法という方法を使ってMAPキナーゼを同定していきました。神経成長因子(NGF)と上皮成長因子(EGF)の刺激で、おなじ2種類のMAPキナーゼが活性化したのです。その2種類にはのちに「ERK1」「ERK2」という名がつきます。こうして種々の細胞増殖因子で共通に活性化するキナーゼを同定できたというのが、私のMAPキナーゼ研究のスタートですね。
審良 以前から対象にされていたMAP2を基質に使ったら研究が進んだのですね。
西田 そこはとてもラッキーでした。当時、タンパク質キナーゼを研究する多くの人たちが、ヒストンまたはカゼインをin vitroの基質に用いていたのです。ところが、これらはMAPキナーゼではリン酸化されません。私は、長らくMAP2を扱っていたので、これを基質に用いたら、うまくいったというわけです。
審良 なるほど。その後、MAPキナーゼの精製をどう進められたのですか。
西田 当時の大学院生が中心となって、大量の培養皿に培養をして、精製しました。実はその後、アフリカツメガエルの卵が精製にとてもよい材料であると見つけたのです。
審良 アフリカツメガエルの卵……。どうしてでしょう。急にそこにたどり着くようには思えないのですが。
西田 正確には覚えてはいないのですが、様々な刺激で活性化するMAPキナーゼですから、卵のように大量に扱える生物材料でも、MAPキナーゼが活性化している可能性があると思ったのです。それで、哺乳類の培養細胞で見つけたMAPキナーゼと相同のMAPキナーゼがアフリカツメガエルの未受精卵の分裂期(M期)において活性化していることを見つけたのです。
それで今度は、アフリカツメガエルの卵を使って、MAPキナーゼをリン酸化により活性化させるMAPキナーゼキナーゼを世界に先駆けて精製することができました。当時、MAPキナーゼを活性化するキナーゼは、MAPキナーゼにあるスレオニン残基とチロシン残基それぞれをリン酸化する2種類の別のものがあると考えられており、私も「探すの、たいへんだろうな」と思っていたのです。ところが精製してみると、1種類のMAPキナーゼキナーゼがMAPキナーゼのスレオニン残基とチロシン残基の両方をリン酸化しているとわかりました。
審良 そうでしたか。その後、先生は、MAPキナーゼに関わるシグナル伝達の経路を解明されていったのでしょうかね。
西田 はい。以前から、MAPキナーゼは細胞質のなかで増殖因子のシグナルを受けて活性化し、核へと移行するのだろうと思われていました。そこで私たちは、抗体を用いて調べたところ、刺激後3~5分でMAPキナーゼがまず細胞質で活性化し、20〜30分経つとそれが核のなかに移行していることがわかったのです。
一方で、海外の研究グループが、MAPキナーゼキナーゼをリン酸化して活性化するのはRAFというキナーゼだというのを報告しました。RAFキナーゼは、RASという低分子タンパク質により活性化されます。さらに、私たちを含め5つほどのグループがその下流でMAPキナーゼが活性化することを見出していまいた。これらから「RAS/RAF→MAPキナーゼキナーゼ→MAPキナーゼ」という活性化の経路を辿り、活性化したMAPキナーゼが核へ移行するということを解明できました。
審良 MAPキナーゼが細胞質から核内へ移行するメカニズムはどのようなもので……。
西田 MAPキナーゼは通常MAPキナーゼキナーゼに結合しています。MAPキナーゼキナーゼは核外移行シグナル(NES)により細胞質に局在することが規定されているので、このときはMAPキナーゼもおなじく細胞質内に局在しています。ところがMAPキナーゼはMAPキナーゼキナーゼの活性化を受けてリン酸化すると解離していき、核内へと移行します。MAPキナーゼキナーゼのほうは万一、核に入ってしまっても、NESがはたらいて核外に出ます。
審良 核に移行したMAPキナーゼは、転写因子などをリン酸化するのですか。
西田 審良先生は転写因子のことをご研究されてきたから気になりますよね(笑)。
審良 興味あります(笑)。
西田 MAPキナーゼは核内に行くと、転写因子をリン酸化します。それにより膨大な遺伝子発現が起きるわけです。

西田栄介 氏
国立研究開発法人 理化学研究所
生命機能科学研究センター センター長
1953年、埼玉県生まれ。76年東京大学理学部生物化学科を卒業。78年東京大学大学院理学系研究科生物化学専攻修士課程を修了。81年東京大学大学院理学系研究科生物化学専攻博士課程を修了。日本学術振興会奨励研究員、東京大学理学部助手を経て、93年京都大学ウイルス研究所教授。97年京都大学大学院理学研究科教授。99年京都大学大学院生命科学研究科教授。2005〜09年に京都大学大学院生命科学研究科長、また12〜15年に日本学術振興会学術システム研究センター主任研究員を歴任。18年より現職。23年より日本学術振興会学術システム研究センター副所長もつとめる。専門分野は細胞生物学、分子生物学。タンパク質リン酸化酵素のMAPキナーゼを発見。MAPキナーゼをはじめとする、細胞増殖・分化ならびに老化・寿命制御のシグナル伝達に関する分子細胞生物学の分野を切り拓く。おもな受賞歴は、日産科学賞、井上学術賞、大阪科学賞、上原賞、武田医学賞、紫綬褒章、日本学士院賞、藤原賞。
発生、さらに寿命における
MAPキナーゼの役割に迫る
審良 続いて西田先生はどのような研究に進まれたのですか。
西田 MAPキナーゼの核移行のメカニズムがわかったのが1990年代中頃。1990年代の中後半は、さきほどお話したアフリカツメガエルの卵を使って、さらにMAPキナーゼのはたらきを解明していきました。
MAPキナーゼキナーゼに対する中和抗体を用いると、卵母細胞の成熟が阻害されました。すなわち、未受精卵ができるための卵母細胞の減数分裂の駆動にはMAPキナーゼ経路が必要ということを明らかにしました。
その未受精卵は、精子がくるまで分裂中期の段階で止まっていて、そうしないと受精できないのです。このとき分裂中期にとどまるために、MAPキナーゼの活性化が必須であることも明らかにしました。
ほかに、MAPキナーゼに特異的にはたらく脱リン酸化酵素のフォスファターゼを胚に導入すると、中胚葉への誘導が阻害され、後部腹側形成の不全が生じました。
審良 そうでしたか。MAPキナーゼは発生にも関わっているのですね。
西田 ええ。さらに2000年代以降、今度は寿命や老化を制御するMAPキナーゼの作用に目を向けています。
審良 今度はどんな動物を対象にされて……。
西田 線虫です。1990年代、線虫において1つの遺伝子を変異させるだけで寿命が3倍伸びたという報告がありました。それを知り「線虫は老化制御などの研究に使えるのか。使ってみよう」と思い、MAPキナーゼと老化・寿命の関係について調べてみたのです。線虫のMAPキナーゼにあたるMPK-1をノックダウンすると、線虫の寿命が20%ほど短くなりました。逆に今度は、MPK-1を特異的に脱リン酸化するLIP-1というフォスファターゼをノックダウンし、MAPキナーゼを活性化させると、線虫の寿命は20%ほど伸びたのです。
MAPキナーゼが細胞を増殖・分化させるはたらきは、酵母から動物まで普遍的にありますが、すくなくとも線虫についてはMAPキナーゼが老化や寿命をも制御しうるということがわかりました。
審良 僕がイメージしていたのは、MAPキナーゼはむしろ寿命を縮めるほうに作用するのではないか、と。成長因子などが関係するしくみに対し、シグナル伝達の仲介があると、寿命を縮めそうな気もしますが。
西田 先生、それは鋭いご指摘です。実際、細胞の増殖が進むと、老化が早くなるから寿命は縮むと思います。
審良 そんな感じはします……。
西田 MAPキナーゼが常時、強く活性化していたら審良先生の仰るとおり寿命は縮むだろうと思います。おそらく「ほどよい」活性化が寿命を伸ばすほうに効いているのだと考えています。さきほど、フォスファターゼをノックダウンし、線虫のMAPキナーゼを活性化させたら寿命が20%伸びたと言いましたが、その場合、活性化の程度はほどほどに抑えられていると考えられますから。
審良 線虫での結果が、哺乳動物にも当てはまるようなことはありそうですか。
西田 あるだろうと見ています。カロリー制限を施すと寿命が伸びるという話があります。線虫に2日おきに餌をあたえる・あたえないといった「断続的飢餓」を繰り返し経験させると寿命が60%以上も伸びるのです。同様のカロリー制限などによる寿命の延長がマウスなどでも起きるとされています。
では、どうして寿命が伸びるのか。それには、ストレス応答性MAPキナーゼのc-Jun N末端キナーゼ(JNK)というものが必要であり、その下流の複数の転写因子の作用で、タンパク質の量や品質などの恒常性を指すプロテオスタシスを制御する遺伝子群の発現が上昇し、寿命が伸びるものと考えています。2000年代後半から2010年代中後半にかけて論文を発表しました。プロテオスタシスが寿命の延長に重要だというのはどの動物にもいえることと思います。
審良 哺乳動物でも、線虫で解明されたような寿命のしくみが保存されていたら、すごくおもしろいことになりますね。
西田 ええ。こうして、MAPキナーゼが増殖や分化のほか、発生や寿命にも重要な役割を果たしているとわかってきたのですが、普遍的な仕組みとして確立したら、ものすごく面白いと思います。
審良 直近は、どのようなことにご興味を……。
西田 ヒトを含む動物の寿命がどのように決まっているのかに興味をもっています。生物の老化は、しくみが備わっているから起きる。けれども、しくみの根本はまだ解明されていないと思います。そこを知りたい。生命の起源の解明にもつながるのではないかと思っています。
チームワークを大事に
一人一人をリスペクト
審良 西田先生がいまも研究に注力しておられることがわかりました。その一方、2018年4月から理化学研究所の生命機能科学研究センター(BDR)のセンター長に就かれています。長らく東大や京大などの大学で活躍されてこられ、いまは理化学研究所。しかもセンター長をされている。心境の変化みたいなものはおありですか。
西田 理研のセンター長は、権限が広範囲におよび、人事、予算、研究計画などにわたってリーダーシップが求められます。だから責任も重大です。就任する前は、研究とマネジメントを半々ぐらいでできると聞いていましたが、実際は8割マネジメントという感じです(笑)。
理研は7年を1期とする中長期計画を立てていて、2025年よりつぎの中長期計画の期間に移ります。国の戦略に基づいてミッションを遂行するような形で変遷していくので、そのあたりは大学とは異なりますね。
現在の理研BDRは、40歳代のなかごろがいちばん厚いPI層になっていて、大学の教授陣よりすこし若い。これからの生命科学を発展させるため、若い人たちの研究力を最大化しながら、ミッションを遂行していくことにも心をくだいています。
審良 先生は、「チームワークを大事に。研究者一人一人をリスペクトする」というモットーをおもちと聞きます。こう考えるに至ったのはどうしてですか。
西田 東大にいたとき、また京大に移ってからもですが、学生たちから学んだことが多くありました。東大時代、私のグループに10人ちかくの学生がきていましたが、みなモチベーションが高く、優秀でもあります。優秀な人には個性も強い面もある。そこで、チームワークの大切さが出てきます。みんなが「自分が」「自分が」とならないように、おたがいが尊重しあえるようになれば、おのずと研究は進むだろうと思うのです。私は研究グループの長ではありましたが、学生たちの発想や意欲にむしろ刺激されて研究のモチベーションを上げてきたところがあります。自然とそうした研究メンバーをリスペクトするようになっていきましたね。
審良 いまの若い研究者たちに、メッセージがありましたらぜひ聞かせてください。
西田 私が言っているのは、「自分がやりたいようにやるのがいい」ということです。それを形にするのは私たちボスの責任です。
審良 僕も先生のお考えと近いところはあります。たとえ、「うまくいかないのでは」と思っても、とにかくやらせてみる。そうすれば、自分で「うまくいかなかった」と納得できますしね。意外な結果が出たときも「それおもしろいね」となる。
西田 研究者を長くやっていると、ほかの人から「こんな結果が出たのですが」と聞き、「ああ、そうか!」となり、前進することがありますよね。そういうことがあったからこそ、ここまで歩んでこられました。
審良 これからのご活躍も祈念しています。
ありがとうございました。
(対談日/2023年10月24日)
EYES
タンパク質リン酸化酵素「MAPキナーゼ」の
発見を起点に、細胞の運命を決定づけ、
個体の生老を制御するしくみを解明
暗闇だった細胞膜から核にかけての
シグナル伝達経路に光を照らす
私たちヒトをはじめとする高等な真核生物の細胞は、増殖をしたり分化をしたりします。これら細胞の増殖・分化は、「細胞増殖因子」と総称されるタンパク質群によって制御されています。細胞増殖因子は、微量で細胞の成長を調節するはたらきをもつタンパク質を総称したもので、細胞の増殖のほか分化を引き起こします。たとえば、神経成長因子(NGF)、上皮成長因子(EGF)、繊維芽細胞増殖因子(FGF)などは細胞増殖因子にあたります。
細胞増殖因子をもととする刺激が、細胞膜上の受容体から細胞内の核へと伝わることにより、細胞の増殖や分化などの運命が決定されるのです。しかしながら、細胞膜から核へと至る細胞内のシグナル伝達経路は、1980年代後半までほぼ未解明といった状況でした。
細胞の運命を決定づけるこのシグナル伝達経路に光を照らし、その分子機構を明らかにしたのが、本対談記事に登場する西田栄介氏です。
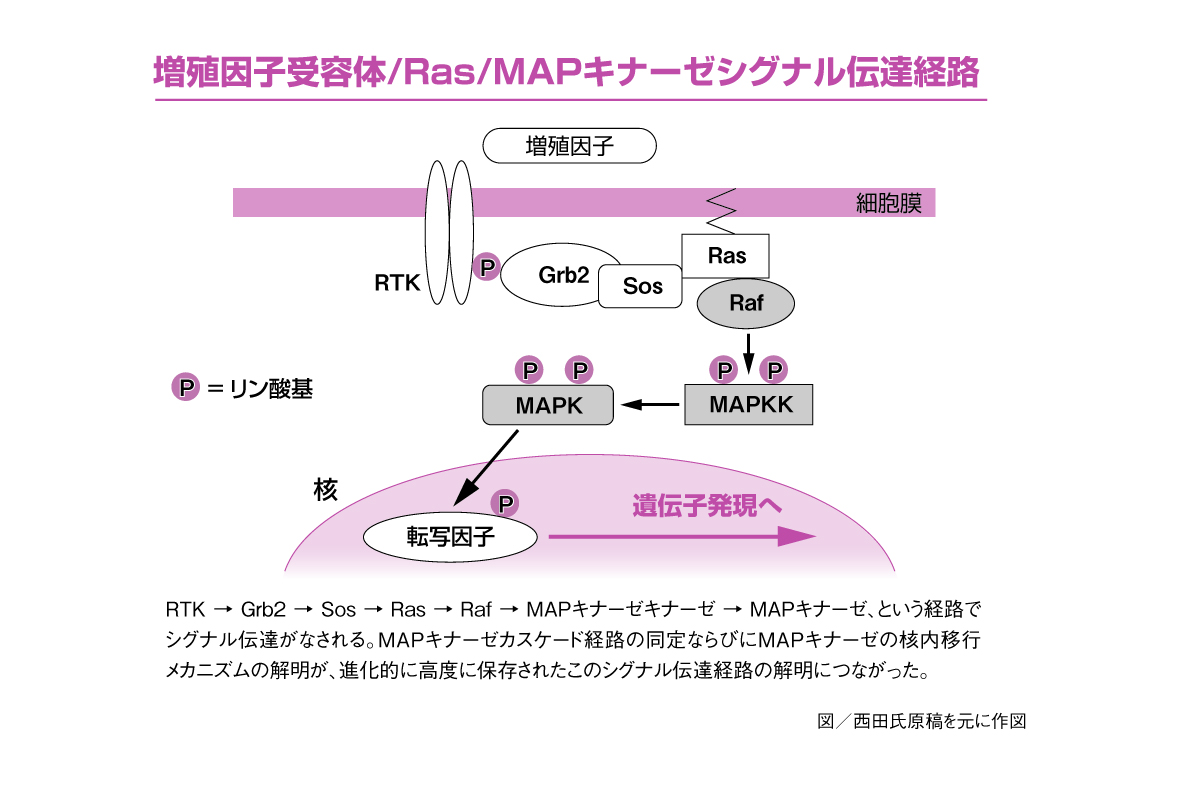
西田氏は1980年代後半、微小管がつくられるしくみを研究するなかで長らく扱っていた「微小管結合タンパク質2」(MAP2:Microtubule Associated Protein 2)を利用して、新たにタンパク質キナーゼを探索しようとしました。MAP2とは、脊椎動物の神経細胞に豊富にあるタンパク質で、チューブリンに結合し、チューブリンとともに微小管を形成しています。また、タンパク質キナーゼとは、あるタンパク質に対して、リン酸化をもたらして活性を変換する作用をもつ酵素を指します。西田氏はMAP2を基質(酵素が作用するときの相手となる物質)に用いることで、効果的にタンパク質キナーゼを探索できると考えました。実際に試してみたところ、細胞増殖因子などの刺激で活性化されるキナーゼを見出すことに成功。このキナーゼはアミノ酸のセリンやスレオニンをリン酸化するキナーゼであり、西田氏は「MAPキナーゼ」と名づけました。なお、こちらのMAPは、「分裂促進因子活性化タンパク質」と訳されるMitogen-Activated Proteinの頭文字をとったものです。つづけて西田氏は、のちに「ERK1」と「ERK2」とよばれることになる2種類のMAPキナーゼを同定しました。
さらに西田氏は、MAPキナーゼを活性化する因子の探索もおこないます。その因子もまたキナーゼであることを見出し、その分子を精製しました。このキナーゼは、「MAPキナーゼをリン酸化を介して活性化するキナーゼ」ということで、「MAPキナーゼキナーゼ」とよばれます。さらに、「MAPキナーゼキナーゼ」の活性化も、その上流にあるキナーゼによってなされることを西田氏は解明しました。MAPキナーゼキナーゼのキナーゼの1つに、「RAFキナーゼ」があります。このRAFキナーゼが線維肉腫の誘導を亢進させることからRapidly Accelerated Fibrosarcomaの頭文字に由来します。
このように西田氏は、上流のキナーゼ(RAFキナーゼ)が下流のキナーゼ(MAPキナーゼキナーゼ)を活性化し、それがさらに下流のキナーゼ(MAPキナーゼ)を活性化するといった連鎖反応の存在を明らかにしたのです。
MAPキナーゼは通常は細胞質に存在しますが、リン酸化により活性化すると核に移行し、転写因子を活性化します。転写因子が活性化することで、遺伝子が発現します。このMAPキナーゼの細胞質から核内への移行メカニズムも、西田氏が明らかにしました。つまり、細胞質にあるMAPキナーゼは、MAPキナーゼキナーゼと複合体を形づくっていますが、MAPキナーゼキナーゼが活性化することで、MAPキナーゼが複合体から離れ、単独で核へと移行していくというわけです。
こうしたMAPキナーゼのシグナル伝達経路は、酵母からヒトに至るまで高度に保存された細胞内情報伝達システムであることが現在わかっています。また、西田氏がこの研究の初期に発見したERK1とERK2以外にも、p38やJNKといった複数の種類のタンパク質キナーゼが「ストレス応答性MAPキナーゼ」として同定され、これらのストレス応答性MAPキナーゼにも特異的なキナーゼの連鎖反応があることがわかっています。
西田氏の飽くなき探究心は、MAPキナーゼの役割が細胞の増殖・分化にとどまらないことをも明らかにしました。卵母細胞の成熟、未受精卵の分裂期中期停止、初期胚発生における中胚葉誘導といった発生の各段階において、MAPキナーゼのシグナル伝達が必須であることを解明。さらに、MAPキナーゼが個体の老化・寿命を制御しうるものであることを、線虫を対象とした研究で解明しています。
MAPキナーゼを介したシグナル伝達経路が、細胞レベルでも個体レベルでも、極めて重要な存在であることが、西田氏の研究で明らかになりました。