LF対談
生命に不可欠な膜をつくっているのは脂質。
生命の誕生と、その質を決める存在だと思っています。 No.100(2023.10)

東京大学 名誉教授
国立国際医療研究センター 脂質シグナリングプロジェクト長
微生物化学研究会 常務理事 微生物化学研究所長
清水孝雄 氏
公益財団法人 千里ライフサイエンス振興財団
審良静男 理事長
「生化学を勉強しないと」臨床医から基礎研究者へ
審良 記念すべき『LFニュース』第100号に、清水孝雄先生をお迎えできたことをうれしく思っています。先生とは2003年、武田医学賞をともに受賞したとき初めてお目にかかりました。
清水 そうでしたね、光栄です。
審良 先生が大学で医学部に進まれた理由はどういったものでしたか。
清水 中学生の頃から小説をよく読み、文を書くのも好きだったので文系に行こうかと思っていたのですが、高校2年のとき職業体験で東京の下町の病院を訪れました。医師や看護師が地域の衛生のため、消毒薬に使われていたクレゾールを背負って家々をめぐる姿を目にしました。それが診察室で大きな椅子に座って患者を待っている医師の古いイメージと違い、印象深く、憧れをもち、医学を志すようになりました。人間と科学を結ぶ学問だと思って。
審良 東京大学医学部に1966年に入学され、その後「東大紛争」に遭われたと聞きます。その期間、先生はどうされていたのですか。
清水 週に一度、クラスで討論会をしたり、自主ゼミで生化学の教科書を読んだり、宇井純さんの公害原論など勉強しました。アテネフランセにも通いました。
審良 授業が再開して、先生は「フリークォーター制」というしくみを大学に提案されたと聞きます。
清水 はい。1年のうち3か月は学生が希望の実習や研修を受けられるようにするというものです。自分たちで時間を使うことに慣れていたこともあり提案しました。
審良 僕が大阪大学医学部に入学したころ、阪大でもいまも続いている似た制度がありました。「基礎医学講座配属」と言い、3年生になると好きな基礎医学講座で自主的な研究をして過ごすのです。偶然か、東大の制度とおなじころ始まりました。
清水 教員も学生も、それまでの決まりきった授業のやり方に、まずいのではと思うようになった時期だったのかもしれませんね。
審良 その後、清水先生は内科医になられたあと、基礎研究の道に進まれました。どういう経緯でしたか。
清水 医師になりたいという思いは当時もあり、呼吸器に興味を持ち、内科に進みました。医学部第三内科です。その後、患者さんを診ているなかで、「いい内科医になるには生化学を勉強しないと」と思うようになりました。ちょうど、アンジオテンシン変換酵素が発見され、肺で作用することがわかった時期で、「いいタイミングだ。生化学を勉強するなら京大か阪大に行こう」となりました。
審良 清水先生も第三内科。僕も阪大の第三内科。「3」のつくところでは臨床医にならず基礎研究者になる人が多いみたいですね(笑)。「1」や「2」でないからか。
清水 ほんとですね(笑)。「3」は亜流内科なんです。それで、京大の早石修先生と、阪大の佐藤了先生の研究室に「生化学を勉強したいので採っていただけないか」と手紙を出しました。早くお返事をいただいたのが早石先生で、早石研究室にお邪魔することになったのです。しばらく臨床と基礎と両方していましたが、結局、基礎の研究に進みました。
生理活性脂質をめぐる酵素・受容体を解明
審良 先生の代名詞である「脂質」の分野に、どのように入っていかれたのでしょう。
清水 早石研究室ではじめ2年間は脂質でなく、アミノ酸の一つ、トリプトファンの代謝を研究しIDO1を初めて単離しました。でも、研究室では2年間ひとつのテーマに取り組んだら、異なるテーマに変えるという方針があり、そこで生理活性脂質のプロスタグランジンに対象を変えたのです。
審良 それから今日までずっと脂質の研究が続くわけですね。先生はスウェーデンのカロリンスカ研究所に留学されました。
清水 はい。1982年、ベンクト・サムエルソン先生の研究室に入りました。ちょうど彼が同年、プロスタグランジンの発見と研究でノーベル生理学・医学賞を受賞されて。私はなにも貢献しませんでしたが。
審良 パーティーには参加できた。
清水 はい(笑)。
審良 サムエルソン先生の研究室で、清水先生はなにを研究されたのですか。
清水 生理活性脂質のロイコトリエンB4が、多価不飽和脂肪酸のアラキドン酸からどのようにつくられるかが私のテーマでした。
まず、アラキドン酸が、5-リポキシゲナーゼという酵素により、5-ヒドロペルオキシイコサテトラエン酸となってから、ロイコトリエンA4という脂質がつくられることを、1984年にジャガイモの持つ酵素で示しました。つまり二段階の反応です。ところが翌年、製薬企業のアボット研究所から「シミズの論文は哺乳類では追試ができない」との旨の論文が出されたのです。曰く、二段階の反応が起きず、生成されるのは5-ヒドロペルオキシイコサテトラエン酸のみだと。これには落ち込みましたが、帰国後、当時徳島大学におられた山本尚三先生、カロリンスカ研究所にいたキャロル・ロウザー、それに東大でポストを得られた私がそれぞれ、独立してアラキドン酸-5-リポキシゲナーゼが二段階の反応を触媒することを証明し、アボット研究所の見解はまちがいだったことを実証しました。どうやら彼らは、活性の弱さから二段階目の反応を見られなかったようです。
さらに研究を進めると、ロイコトリエンA4に対し、ロイコトリエンA4水解酵素という酵素が作用して水酸基がつき、ロイコトリエンB4になることを解明できました。サムエルソン研究室時代からの宿題を果たせたわけです。その後、ロイコトリエンB4で知られていた白血球を遊走させる機能をめぐって、鍵となる二つの受容体を見つけ、1997年と2000年に発表しました。
審良 もうひとつ、清水先生の研究成果でとても話題になったのが、別の生理活性脂質である血小板活性化因子(PAF)の受容体を発見されたことです。1991年でしたか。
清水 はい。もともとロイコトリエンの受容体をクローニングしようとしていたのですが、最初に見つけたのはPAFの受容体でした。話題になったのは、脂質の受容体もペプチドなどの水溶性分子が結合する受容体とおなじように、7回膜貫通型であることを示せたからだと思います。この研究では、早石研究室時代に先輩だった中西重忠先生が当時おられた京都大学の研究室に1週間ほど滞在し、アフリカツメガエルの卵母細胞で候補遺伝子をはたらかせ、細胞膜上に受容体を発現させる方法を教わるなどしました。
その後、ロイコトリエン受容体や、別の生理活性脂質であるリゾホスファチジン酸の受容体も同定することができました。
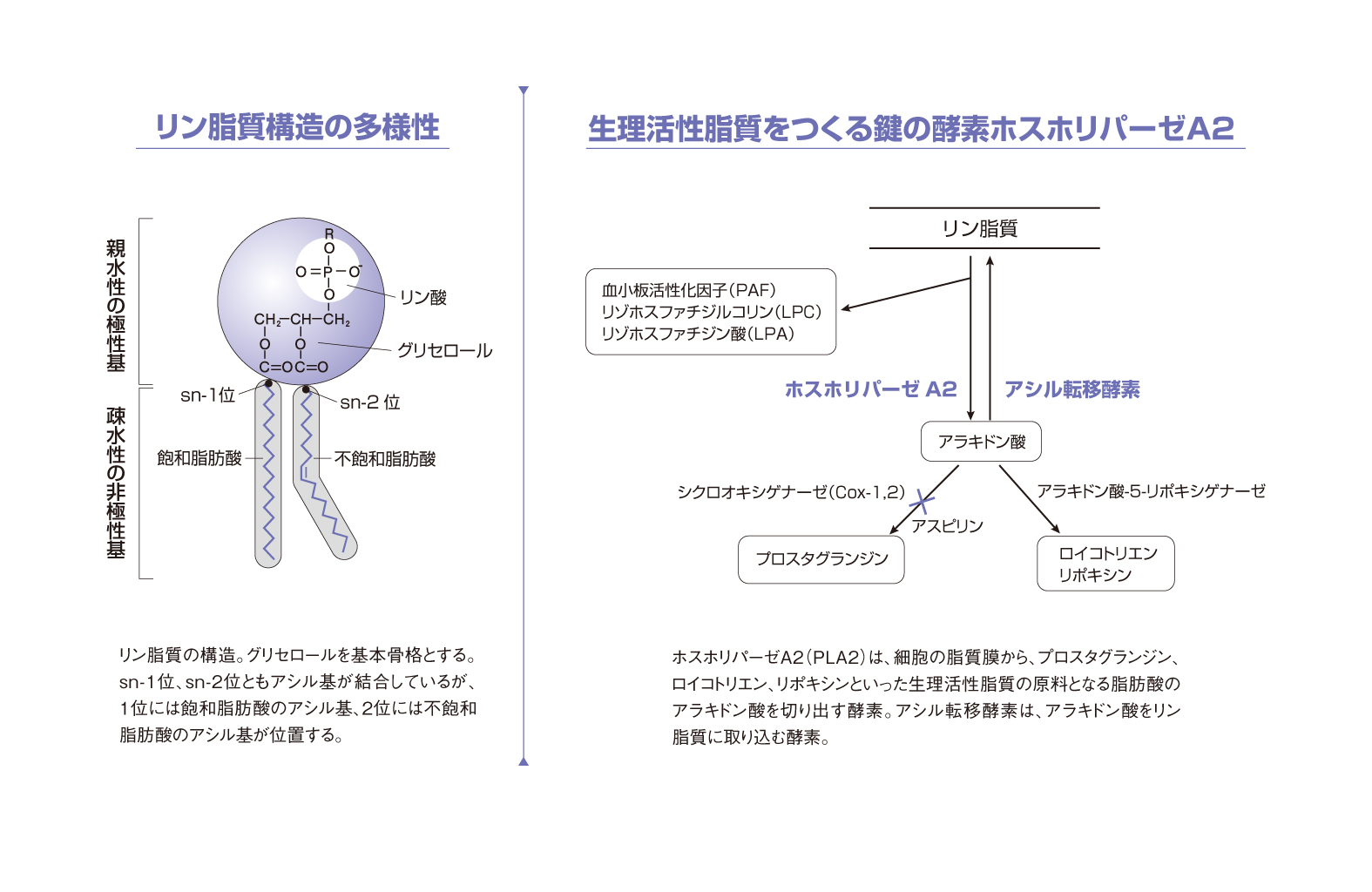
審良 受容体の研究と並行して清水先生は、脂質膜から生理活性脂質の原料となる脂肪酸を切り出す酵素にも興味をもたれたのですよね。ホスホリパーゼA2という。
清水 ええ。プロスタグランジン、ロイコトリエン、PAFなどを研究していると、興味がだんだん上流に移っていきまして……。これらの生理活性脂質は、細胞の脂質膜のリン脂質に対し、酵素のホスホリパーゼA2が加水分解のはたらきをすることでつくられます。研究で、ホスホリパーゼA2の一種である細胞質型ホスホリパーゼA2(cPLA2)をマウスで欠損させると、気管支喘息や急性呼吸窮迫症候群の軽減、ブレオマイシン肺線維症の緩和、血栓塞栓症による死亡率の削減などなど、たくさんの表現型が現れました。この酵素を阻害するしくみを活かせば優れた薬ができるのではと考え、製薬企業と協力したのですが、第三相臨床試験まで行って中止になるなど、残念ながらまだ成果は出ていません。当時、吸入ステロイドや抗体医薬の進展など、タイミングのむずかしさもありますね。
リン脂質をめぐる非対称性と多様性の謎を探究
審良 東大におられた時期の後半、清水先生はどのようなご研究を……。
清水 じつは2003年が、私にとって大きなターニングポイントでした。この年、「ヒトゲノム計画」で遺伝情報の解読完了が宣言されましたが、私は55歳で東大にいられるのはあと10年。やるべきことを考えました。そして「どうして細胞膜の主成分であるリン脂質のsn-2位の位置に、多価不飽和脂肪酸のアラキドン酸があるのだろう」との疑問を解明しようと決めたのです。
審良 なぜその研究しようとしたのですか。
清水 「生物学的な意味があるのではないか」と考えたからです。さきほどお話ししたホスホリパーゼA2の「2」は、「2位の結合を切ること」に由来します。1位にあるのは飽和脂肪酸で、2位にあるのはアラキドン酸などの不飽和脂肪酸。この非対称性はどうしてできるのか。さらに、わざわざ脂肪酸の種類を変えて、千種類以上の膜のリン脂質をつくっている。この多様性には、両親媒性を利用した膜というバリア機能以上の意味があるのでは、と考え、研究に取り組んでいます。
審良 膜の構成成分からさまざまな生理活性脂質ができる。たしかに不思議ですね。
清水 私が抱いた疑問を解くには、脂質を網羅的に定量できるリピドミクスとよべるようなシステムをつくらなければならないと考えました。幸い、長年お付きあいのあった小野薬品工業と島津製作所に出資していただき、2003年、「リピドミクス寄付講座」を設置することができました。
審良 どんな成果を得られましたか。
清水 リン脂質や、それからできる生理活性脂質の網羅的解析が可能となりました。また、リン脂質がつくられるときの酵素のはたらきなどの実態を解明することができました。リン脂質がどうできるかは、米国のユージン・ケネディが1956年に報告した「ケネディ経路」と、1958年におなじく米国のウィリアム・ランズが報告した「ランズ回路」という二つの経路で説明されています。ケネディ経路で原始型のリン脂質がつくられ、ランズ回路でリン脂質が成熟し、非対称性を作るといった関係にあります。ところが、これらのしくみにおいて、ランズ回路の酵素の実態はわかっていませんでした。それで、私たちはぜんぶで15個ぐらいある関連酵素のうち、10個ほどの酵素の遺伝子を調べました。初めに同定できたのは「リゾホスファチルコリンアシル転移酵素」(LPCAT)。これは、リゾリン脂質のリゾホスファチルコリン(LPC)に対して2位に脂肪酸(アシルCoA)を入れ、リン脂質のホスファチジルコリン(PC)をつくる酵素です。
2位に入れる脂肪酸を決める酵素がこのようにLPCATだという場合は、ランズ回路で「1位に飽和脂肪酸が、2位に多価不飽和脂肪酸ができる」と説明されているので、説明どおりといえます。ところが、2位に入れる脂肪酸を決めるのはLPCATだけではありませんでした。研究室の大学院生が取り組んだことですが、LPCATとは別に「リゾホスファチジン酸アシル転移酵素」(LPAAT)も2位に入れる脂肪酸を決めていて、こちらのほうは先ほどお話ししたケネディ経路ではたらく酵素です。最初は不思議に思ったのですが、実際、実験をしてみると、たとえば、アラキドン酸が2位に入るのはランズ回路で決まり、別の不飽和脂肪酸であるドコサヘキサエン酸(DHA)が2位に入るのはケネディ経路で決まるといった、役割分担が見えてきました。
LPCATについてはその後、類縁体が4個得られたので、最初に同定したものをLPCAT1とよんでいます。新たに同定したLPCAT2については、LPCAT1と48%ホモロジーですが、アセチルCoAを2位に入れて、血小板活性化因子(PAF)をつくるのです。私たちは、先ほどお話ししたようにPAFの受容体を発見できていたので、酵素のほうもねらっていました。偶然、LPCAT1のホモロジーでとれたLPCAT2がそれでした。
この研究は、審良先生との共同研究の成果でもあるのです。
審良 ノックアウトマウスを清水先生に提供したのでしたね。
清水 はい。審良先生にいただいたノックアウトマウスを使うことで、酵素がToll様受容体4を介して誘導されると共に、30分ほどでリン酸化され、活性化されるといった経路があることもわかりました。LPCAT2については、これを発現しないようにしたマウスは神経因性疼痛モデルで痛みを感じないことがわかり、鎮痛剤の開発が進むなどしています。
また、LPCAT3については、そのノックアウトマウスが、腸細胞の脂肪変性による栄養失調と低血糖で新生児段階で死ぬことがわかりました。アラキドン酸を含むリン脂質が中性脂肪(トリグリセリド)の輸送とリポタンパクの産生に重要であることがわかったのです。小胞体の膜に中性脂肪が貯まることはわかっていました。その運び込みや引き抜きにミクロソームトリグリセリド輸送タンパク質(MTP)がはたらくものの、アラキドン酸を含まない膜の場合、中性脂肪が輸送されにくいといったことが、in vitroでわかってきました。
審良 ドコサヘキサエン酸(DHA)を対象とした研究もされているのですか。
清水 はい。先ほど、LPAATがケネディ経路において、DHAが2位に入るのを決めているという話をしましたが、この経路で本当にDHAが入るのかを確かめようとしたものです。LPAAT1、LPAAT2、LPAAT3など、5種類の酵素を単離したところ、LPAAT3を欠損した雌マウスが不妊になりました。精子が成熟していくとき小管小胞複合体(TBC)という小器官をつくり、精子の不要となった細胞質体を、50nmほどの径の穴の通過を経て取り除くはたらきをしているのです。おそらく、この小孔の通過にDHAのもつ膜のやわらかさが重要であり、DHAがないと精子の細胞質体が過剰に残り、受精能がなくなるのだろうというのが、私たちの仮説です。おなじようなしくみが網膜や神経細胞でも考えられ、ともにしくみを解明していきたいと考えています。

清水孝雄 氏
東京大学 名誉教授
国立国際医療研究センター 脂質シグナリングプロジェクト長
微生物化学研究会 常務理事 微生物化学研究所長
1947年、東京都生まれ。73年東京大学医学部を卒業。79年京都大学医学部助手。82年カロリンスカ研究所客員研究員。84年東京大学医学部助教授。91年同教授。2007年同医学部長・医学系研究科長。11年東京大学理事・副学長。12年国立国際医療研究センタープロジェクト長、東京大学名誉教授。13年国立国際医療研究センター研究所長。17年微生物化学研究会常務理事、22年微生物化学研究所長。専門分野は、生理活性脂質、膜脂質代謝。生理活性脂質の代謝と機能に関する研究の第一人者。細胞機能に必須であるグリセロリン脂質膜の多様性や非対称性に注目し、その解明のためアシル転位酵素ファミリーを多数単離。おもな受賞歴は、日本生化学会奨励賞、ドイツ エルンスト・シェリング賞、日本医学会医学賞(基礎医学)、持田記念学術賞、武田医学賞、上原賞、日本学士院賞、瑞宝中綬章、Life time achievement award from the Eicosanoid Research Foundation。
複雑かつ膨大な研究対象
異分野融合への課題意識も
審良 いまも清水先生は研究室をもっておられるわけですね。
清水 はい。東大を退職したあと、同級生の春日雅人先生にお招きいただき、国立国際医療研究センターに研究室をもつことになりました。実験動物とヒト検体を扱える充実した環境です。それと2022年から、微生物化学研究所で研究所長をつとめさせてもらっています。天然物から新たな生理活性物質や酵素阻害剤を見つけたいと思っています。
審良 先生の目から、日本の脂質研究は世界のなかでどんな状況に映りますか。
清水 とくに化学関連の分野は伝統的に強みがあります。また、産業競争力強化委員会の報告でも、世界をリードできる分野に脂質が入っています。そういう伝統を受け継ぎつつ、今後やはり生物学としての脂質研究を伸ばしていかなければなりません。
審良 僕もいま、免疫の研究に必要なため脂質の勉強をしているのですが、むずかしさは感じますね。構造式を見ても、それがなにを意味しているのかと……。
清水 でもやはり、生命に不可欠な膜をつくっているのは脂質ですし、エネルギー源としてこれほど効率のよいものはないし、さまざまな生理活性分子を含む。とても重要な存在と思っています。
審良 この財団でも、免疫の研究者と脂質の研究者の融合をはかる試みをしてきましたが、まだおたがい理解しきれていないという感はあるのです。
清水 ほかの分野の方にとって、脂質の構造が複雑なものだし、種類も1万以上あるし、むずかしいところはあるのでしょう。私自身も専門のリン脂質や脂肪酸でない部分にむずかしさを感じますから。
審良 どうしていけばよいと思われますか。
清水 まず、生化学教科書レベルで脂質の分類や大まかな構造を知る。ついで、たとえば、ホスファチジルセリンは1種類でなく30種類ほどあって、それぞれ性質が異なるといったぐらいの概略は知っておいていただくことです。自分の研究で必要となればさらに細かいところを勉強し、脂質学者と共同するということですね。といったことになるでしょうか。幸い、脂質の分子については、さまざまな代謝経路や遺伝子がわかってきて、膜脂質操作がだいぶ簡単にできるようになってきています。また、操作で脂質が変化したかどうかを解析する技術(リピドミクス)も発展しています。
審良 最後に、若い人たちに向けてのメッセージをお願いできますか。
清水 よい研究は、共同研究によってなされるものです。よい共同研究をするには、やはり人間性が重要ではないかといつも思っています。私はよく「高い志と低い姿勢」と言っていますが、新しい仕事をしたいという気持ちと人に感謝する気持ちを忘れないということが大切ではないでしょうか。
審良 今日はありがとうございました。
(対談日/2023年6月27日)
EYES
脂質は生命活動や生理機能にかかわる「生命の源」
生理活性脂質のはたらきとつくられ方を解明
数多くの酵素や受容体を同定
根源的な非対称性や多様性の謎に迫る
脂質は、タンパク質や糖質とともに生体をつくる大切な物質群です。水に溶けず、エーテルやベンゼンなどの非極性溶媒に溶ける細胞内有機物が脂質であるとされます。化学構造的には、長い炭化水素鎖からなる疎水性の非極性基と、エステル基・ヒドロキシ基・糖・リン酸基などからなる親水性の極性基という、二つの部分から成り立っています。この性質を両親媒性と呼びます。
脂質には、エネルギーをつくる栄養素ながら、摂りすぎると肥満や脂質異常症を引き起こすといったイメージがよくもたれます。しかしながら、脂質がもたらすものはそれだけではありません。生体膜を構成したり、タンパク修飾をしたりするほか、免疫、炎症、生体防御、血圧調節、出血凝固、消化管活動、細胞増殖といったじつに多様な作用をもっていることがわかっています。このような生理作用をもつ脂質を「生理活性脂質」あるいは「脂質メディエーター」といいます。たとえば、血管を拡張させる、血圧を低下させる、平滑筋を収縮させるなどのはたらきをするプロスタグランジンや、炎症やアレルギーを媒介するロイコトリエンは、いずれも生理活性脂質です。
脂質を「生命の源」と捉え、さまざまな生理活性脂質のはたらきやつくられ方を長年にわたり研究してきたのが、対談に登場する清水孝雄氏です。
生理活性脂質は、細胞の脂質膜から原料となる脂肪酸が切り出されることでつくられます。その切り出す役割をもつのが各種の酵素です。清水氏は、細胞膜をつくるおもな成分であるリン脂質のsn-2位とよばれる部分から多価不飽和脂肪酸のアラキドン酸を切り出す酵素「ホスホリパーゼA2」を解析しました。さらに、遊離したアラキドン酸を代謝して、5-ヒドロペルオキシイコサテトラエン酸を経て、生理活性脂質のロイコトリエンをもたらす酵素「5-リポキシゲナーゼ」と「ロイコトリエンA4水解酵素」も単離同定しました。これらにより、生理活性脂質の生合成や分解の経路を明らかにしてきました。
また、生理活性脂質が生理活性のはたらきをするときは受容体との結合が必要となります。清水氏は、生理活性脂質のひとつで、血小板の凝集や、白血球の活性化、炎症やアレルギー反応に関与する血小板活性化因子(PAF)の受容体の遺伝子をクローニングしました。これは生理活性脂質が細胞膜受容体を持つという世界初の報告となりました。さらに、おなじくロイコトリエンや、リゾホスファチジン酸(LPA)の受容体の遺伝子もクローニングし、これらの遺伝子改変マウスを作りました。生理活性脂質のはたらきを明らかにしたことは、気管支喘息などの生理活性脂質が関与する病気の治療薬開発を進めることにもつながっています。
さらに清水氏は、生体膜の主要成分であるリン脂質に着目。その構造の非対称性や、種類の多様性がどうして起きるのかという根源的な疑問の解明をめざし、研究を進めています。この研究において、活性型脂肪酸(アシルCoA)をリゾリン脂質のOH基に結合させる一連の酵素群「アシル転位酵素」ファミリーの10の遺伝子を単離しました。近年の脂質研究のBreakthrough的研究(B.Antonny)と評価されています。
これらの清水氏の業績はいずれも、脂質から生命現象を解読するための重要な知見をもたらすものです。また、病気のメカニズム解明や治療法開発にも貢献するものでもあります。対談記事で「生命の源」を研究する清水氏の、飽くなき挑戦の歩みをぜひ追いかけてみてください。