LF対談
生物学の基本命題を解明しなければならないと考えたのです No.103(2024.10)

京都大学 名誉教授/大学院医学研究科 健康加齢医学講座 特任教授
鍋島陽一 氏
公益財団法人 千里ライフサイエンス振興財団
審良静男 理事長
複数の遺伝子から一つのタンパク質が
つくられるなら、逆もある
審良 鍋島先生とは1980年代から1990年代、転写研究班のメンバー同士でよくお会いしたものです。とはいえ先生の研究分野は発生、次いで代謝で、私の分野は免疫となり、その後お会いすることもなくなりました。でも最近、非アルコール性脂肪肝炎(NASH)の研究をしていて、鍋島先生の代表的な研究内容であるKlothoの話がよく出てくるので、今回お会いするのを楽しみにしていました。
鍋島 よろしくお願いします。
審良 鍋島先生は1972年、新潟大学医学部を卒業されました。医者にならず研究者の道を進まれましたね。
鍋島 医学部に入ったけれど、授業はおもしろくありませんでした。医師として一人ひとりの患者に向き合うか、病気の本態の解明に挑むかの選択でした。幸い、私が学生時代を過ごした1960~70年代はDNAの二重螺旋の解明に引き続く生物学の躍動の時代でした。DNAの複製、転写、翻訳と続くセントラルドグマが解明され、トランスポゾンが見出されたり、多くの発見がありました。「生物は美しい。生命現象はおもしろい」、「生命の本質に迫りたい」、「生物学の基本命題を解明しなければならない」と考えたのです。基本命題は生物界の「統一性」と「多様性」と考え、統一性という名の手のひらに乗った多様性の解明を選択しました。多様性には種の多様性と生物を構成する細胞の多様性や機能の多様性があると考えたのですが、種の多様性に取り組む手立てが思い浮かばず、生物を構成する細胞や機能の多様性の理解、多様性が生み出される仕組みの解明に取り組むこととしました。
審良 それで、大学院に進まれたのですね。
鍋島 ええ。ところが、自分のやりたいことをすぐにやらせてもらえるわけではない。教授とはテーマを巡って色々あったのですが、先輩の助言もあって、大学院のテーマを通して自分のやりたい研究につながる手技を学んでおくこととしました。
そうしたなかグロビン遺伝子がクローニングされ、DNA配列が報告されたのです。1975年のことです。「この方法で発生生物学に取り組もう」と決心しました。
審良 研究対象にしたのが、筋肉の収縮に関連するミオシン軽鎖タンパク質ですか。どうしてこれを対象に……。
鍋島 対象として筋肉の発生・分化メカニズムを選択しました。筋芽細胞から筋管細胞がつくられる過程は培養細胞でも再現でき明確で分かりやすく一人でも研究できると考えました。次にどの遺伝子を解析するかですが、ミオシン軽鎖1、3タンパク質のN端側は異る配列ですが、C端側は同一で、しかもニワトリとウサギの軽鎖1タンパク質のC端側の配列を比較すると27個のアミノ酸変異があり、またミオシン軽鎖3同士を比べても、やはり27個の変異があり、しかも変異が入る場所も同じ、変異したアミノ酸配列も同じ。「もし、1と3が異なる遺伝子の産物なら、このようなことは起こり得ない。C端側は同じ遺伝子の産物にちがいない」。けれども、ニワトリとウサギのミオシン軽鎖1、3のN端側の一次構造は異なっており、異なる遺伝子領域にコードされている。「きっと未知の機構があるにちがいない」と考えました。
審良 当時、私もB細胞の膜型と分泌型のちがいに興味をもち、調べようとしました。でも、どうやったらいいかわからなかった。
鍋島 おっしゃる通りです。当時は遺伝子クローニングや遺伝子配列の決定などができるところは2、3箇所しかなかったと思います。私は、80年の末に癌研の村松正実先生を訪ね指導をお願いしました。当時の癌研は大変混み合っており、スペースがないと言われて新潟に帰ったのですが、「明日から来なさい」との電話があり、すぐに飛んでいき藤井先生の指導で一通りの実験手技を学び、幸運にもcDNAクローニングに成功しました。6ヶ月間の夢のような国内留学でした。新潟大学に帰り遺伝子実験室を立ち上げ、解析に集中しました。
審良 ゲノムを読んだのですか。
鍋島 すべて読みました。15キロ塩基です。その結果、選択的スプライシングの機構が浮かび上がりました。一つの遺伝子から複数のタンパク質が合成されることが証明できたのです。タンパク質の多様性を生みだす重要なしくみです。1984年、ほとんど修正することなく『ネイチャー』に発表できました。
審良 そもそもどうして、一つの遺伝子から複数のタンパク質が合成されるという発想が浮かんだのですか。
鍋島 それは、利根川進先生が複数の遺伝子から一つの免疫グロブリンタンパク質が作られる仕組みを報告したからです。その仕組みがあるなら、逆に、一つの遺伝子から複数のタンパク質ができるのではないかと考え、タンパク質の配列を眺め、軽鎖1、3に行き当たったのです。
審良 なるほど。当時、選択的スプライシングの研究の競争は激しかったですか。
鍋島 大競争でした。僕たちと、フランスのパスツール研究所、米国ハーバード大学、国立衛生研究所(NIH)が競っていました。
審良 「自分の考えていることは、他に3人は考えている」という鉄則どおりですね。
鍋島 激しい競争のなか、ライバルの論文を査読する機会もありました。重要だったことに、多くの方々は他人を邪魔することなく公平に査読したようでした。
審良 平和は保たれたのですね。免疫の分野ではなかなかそうはなりません(笑)。
筋肉形成の「細胞系譜」を決定
いち早くノックアウトマウスを活用
審良 その後、筋細胞の研究をさらに進められましたね。鍋島先生のいわばヒット作の一つだったろうと存じています。
鍋島 ちょうどそのころ、MyoDファミリーという転写制御因子群が発見され、線維芽細胞にMyoDを発現させると筋肉細胞に分化することが発見されました。
審良 米国のハロルド・ワイントロープ氏によるものですね。私もあの発表が出たときは、こんなことがあるのかと驚きました。
鍋島 残念なことに彼は1995年にお亡くなりになりましたが、もし生きていればノーベル賞を受賞したことと思います。
私たちはミオシン軽鎖遺伝子の転写制御領域に結合する分子を解析していたのですが、その分子がMyoD/Myogeninだったのです。そこでMyogeninノックアウトマウスの作製を始めたのです。他の研究グループとの競争の末、Myf5とMyoDが中胚葉の前駆細胞から筋芽細胞への決定を制御し、Myogeninが筋芽細胞から筋管細胞への分化を制御することが明らかとなったのです。筋細胞系譜における決定と分化を制御する遺伝子カスケードが決まったのです。同時にショウジョウバエで、因子の名称などは異なっているものの全く同じ仕組みで神経細胞が形成されることが報告されたのです。種を超え、臓器種を超え、同じ機構で制御される、「これ以上の発生分化のしくみはもう出せない。非常に重要な概念にたどりついたんだ」と思いました。
同時に私の研究室ではもう一つの重要な概念の提唱に取り組んでいました。非対称分裂の分子機構です。松崎さんはハエの神経発生に取り組んでいたのですが、解析していたタンパク質の染まり方に“偏り”があることに気づいたのです。解析の結果、神経幹細胞で発現するProsperoタンパク質が細胞質の一方に偏り、細胞分裂の際にProsperoがある細胞(神経細胞に分化)とない細胞(幹細胞に戻る)に分かれることを発見したのです。さらにこのProsperoの偏りをMirandaタンパク質が引き起こしていることもわかりました。“タンパク質の偏り”と“細胞分裂面の制御”の組み合わせにより非対称分裂が生まれるのです。非対称分裂がなければ生物を形作ることはできません。私が関わった第2の基本概念でした。
筋肉に話しを戻しますと、Myogeninのノックアウト論文は日本から最初に『ネイチャー』に発表されたものでした。
審良 日本初だったのですか。
鍋島 ええ、私どもの論文が発表され、多くの方々が日本でも「できる」と思い、弾みがついたと思っています。今となっては「誰がやったか」は忘れられていますが(笑)。
審良 私は、ノックアウトマウスを使ってスクリーニングをかけて、MyD88という遺伝子に行き当たったりしました。
鍋島 先生のその研究、覚えていますよ。先生のラボでは一体幾つの遺伝子をノックアウトしたのだろうか? とも。
審良 「これ以上の発生分化のしくみはもう出せない」というところまで辿りついたとなると、その先どう進まれたのですか。
鍋島 研究室のメンバーからも、「この後どうするんですか」と言われました。

鍋島陽一 氏
京都大学 名誉教授/大学院医学研究科 健康加齢医学講座 特任教授
1946年、新潟県出身。72年新潟大学医学部を卒業。76年医学研究科博士課程を修了、医学博士。同大学医学部助手、講師、癌研究会研究員、主任研究員を経て、87年11月国立精神・神経センター神経研究所遺伝子工学研究部長に就任。大阪大学細胞生体工学センター教授を経て98年、京都大学大学院医学研究科教授に。日本学術会議第20期、21期会員、京都大学附属ゲノム医学センター長、京都大学生命科学系キャリアパス形成ユニット長を務め若手研究者の育成に尽力。2010年3月定年退職し、先端医療振興財団先端医療センター長に。2022年4月より京都大学大学院医学研究科健康加齢医学講座(寄附講座)特任教授、現在に至る。専門分野は分子生物学。Alternative splicing機構の発見、筋・神経系の系譜決定と分化、生殖幹細胞の振る舞いの解析、α-Klotho、β-Klothoの発見を基盤とした恒常性維持機構の研究を通して「個体形成の根本原理の理解と機能維持の分子機構の解明」に取り組む。主な受賞歴は瑞宝中綬章、持田記念学術賞、日本学士院賞、日本内分泌学会マイスター賞、紫綬褒章、文部科学大臣表彰科学技術賞、武田医学賞、上原賞、ベルツ賞など。
α-Klothoを起点とする
カルシウム恒常性のしくみを詳らかに
審良 鍋島先生の研究の代名詞といえるKlothoの研究はどう始まったのですか。
鍋島 世界ではショウジョウバエ、線虫、それにマウスを対象にサチュレーションミュータジェネシス(全遺伝子変異誘発)が試みられていました。新しい予想を超えた現象やその責任遺伝子を探索して解析する方法です。小規模ですが我々も試みまして見つかったのがKlotho変異でした。
審良 私たちの研究室でも、ミュータジェネシスを推すグループと、ノックアウトからスクリーニングをかける私どものグループがありました。自分としてはノックアウトのほうが、どの遺伝子が表現型に関与するか初めからわかるからよかったなと。
鍋島 たしかに、ミュータジェネシスはランダム変異導入ですから、かけあわせの初期の段階で面白い現象や狙った変異に出会えば良いのですがなかなか見つからないと大変ではありますね。でも、大発見につながるのはミュータジェネシスの方ではないかと思っていました。
審良 マウスを入れるケージがたくさん必要だし、お金はかかったでしょう。
鍋島 一般にはそうです。私は当時、厚生省(現・厚生労働省)所管の国立精神・神経センターにいて、マウスを使うことについては恵まれた環境でした。そうしたなか、Klothoを見つけました。いわば偶然の産物なのです。
審良 鍋島先生の最も代表的な業績はKlothoだと思っていたのですが……。
鍋島 マウスを扱うことができればだれにでもできる方法ですが、問題はできた多数の変異マウスのどれを解析するかです。ここに研究者のセンス、考え方が出るのです。私どもは発生異常を選ばず、生後に変異が現れるものを選んだのです。ここが勝負の分かれ目でした。また外来遺伝子の挿入部位を同定する仕組みに工夫があって、簡単に原因遺伝子を同定できました。とはいえ多彩な表現型がたった一つの遺伝子の異常によるものだったことには私も驚きました。しかも老化のような症状が生じることから有名になってしまい、いまも「ナベシマ=Klotho」になっているのでしょうね。
審良 なっていると思います(笑)。
鍋島 Klothoの機能の解析が進んだのは、α-Klothoの変異表現型と、FGF23の変異表現型がそっくりだったことがきっかけでした。この二つは、機能的クロストークと分子間相互作用をしており、α-KlothoはFGF23のシグナル伝達に必須だったのです。そのシグナルの行き先は活性型ビタミンDの合成を担うシトクロームP450ファミリー27(CYP27)です。またα-Klothoは腎臓におけるリンの再吸収制御にも関わります。
審良 この経路がうまく働かないと、ビタミンDはどうなるのですか。
鍋島 大量につくられてしまいます。つまり、α-Klotho/FGF23はビタミンD合成を負に制御していたのです。
審良 えてして、ネガティブな制御因子が失われるほうが、影響は大きいですよね。
鍋島 ええ。じつは、活性型ビタミンDが過剰だと、脂肪が分解されて萎縮してしまいます。同時に活性型ビタミンDは重要な糖代謝制御因子でもあります。α-Klothoが欠失すると活性型ビタミンDが過剰につくられ、電解質、糖質、脂質代謝、エネルギー代謝が異常となります。
審良 α-Klothoは、カルシウムの恒常性にも重要なはたらきをもっているのですよね。
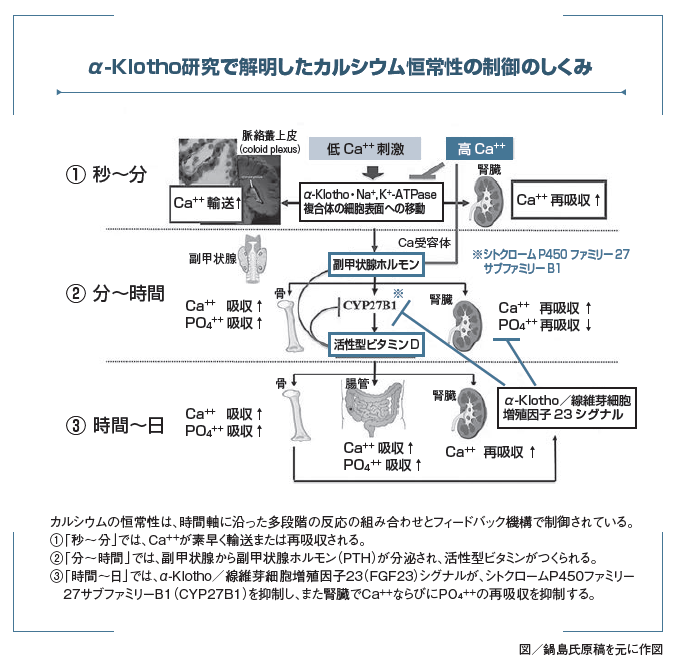
鍋島 そうです。わかったことは、細胞外カルシウム濃度が下がるとKlothoとNa+,K+-ATPaseの複合体が細胞表面に移動し、Na+の濃度勾配の変化により腎臓や脳の脈絡叢でのカルシウムの再吸収や輸送が起こり、副甲状腺ホルモンの分泌が誘導され、さらにビタミンD合成が制御され、カルシウム濃度が上昇します。そしてカルシウム濃度が上がるとこの応答は止まります。生命は細胞外・血中カルシウム濃度を常に一定に保たなければなりません。重要なことに、「秒~分」の早さでα-Klotho・Na+,K+-ATPase複合体が細胞膜に移動し、「分~時間」の早さで副甲状腺ホルモンが分泌され、「時間~日」のスパンでビタミンDが作動します。これらの三つの経路が相互に反応し制御し合うことにより絶えずカルシウム濃度が一
定に保たれていると提唱しています。
審良 鍋島先生は、α-Klothoに続いて、β-Klothoの同定と機能解明もされましたね。
鍋島 はい。β-KlothoはFGF19と共役して肝臓で胆汁酸・コレステロールの代謝制御を担っています。α-Klothoがミネラルの恒常性を保つのととても似たしくみで、β-Klothoは脂質の恒常性を保っています。審良先生のNASHの研究でも、β-Klothoは出てくると思います。
審良 よく出てきます。
鍋島 必要とあればマウスをさしあげます。
老化研究で認知症は
最大のテーマ
審良 鍋島先生は、2022年4月より京都大学医学研究科の健康加齢医学講座で特任教授をされています。いまの研究はどういったものですか。
鍋島 Klothoに関連する研究に加えて、新たに認知機能の低下をできるだけ抑えるための医療イノベーションに取り組んでいます。具体的には音声認識人工知能を用いて高齢者の認知機能を6~7分ほどの電話応答で測るサービスに関する共同研究をNTTコミュニケーションズとしています。認知症では、軽度認知障害(MCI)とよばれる段階での早期の気づきがすべてといえるほど大切です。ですから、いつでも、どこでも、だれでも簡単に受けられる判定技術が必要なのです。現在、電話応答サービスの高度化、血液診断法の開発、認知機能の低下をもたらすリスク因子の解析、介入法の開発に取り組もうとしています。
それで審良先生、認知症の一番のリスク因子はなんだと思いますか。
審良 なんでしょう……。
鍋島 Lancetによりますと若いときの教育不足なのです。
審良 若いとき、頭を使っていなかったとなるとよくないわけですか。
鍋島 はい。「成績はともかく、若いときに頭を使いなさい」がメッセージです。
審良 そもそも、認知症の研究をされるようになったのはどうしてでしょうか。
鍋島 以前より、「認知症は将来かならず大きな問題になる。老化研究で認知症は最大のテーマとなる」とずっと思っていたものの、どこから手をつけてよいか見えませんでした。そうしたなか、星美奈子さんという東大理学部出身の方が私の研究室にきました。星さんは、アルツハイマー病の原因物質と考えられているアミロイドβフィブリルが多いにも関わらず発症しない方が多くいることに疑問を抱いたのです。そして、アミロイドβが30個ほど重合した重合体が神経細胞死をもたらすことを見いだし、アミロスフェロイド(ASPD)と名づけました。ついでASPDが神経細胞で発現しているNa+,K+-ATPase a3サブユニットに結合し、その機能を障害して神経細胞死を起こすことを突き止めました。抗ASPD特異抗体やASPDとa3サブユニットの結合阻害剤の開発など、治療法の開発に発展すると期待しています。
また、NTTコミュニケーションズとの共同研究の開始もベストタイミングでした。医療イノベーションはディジタルメディシン、ディジタルヘルスへと展開する時を迎えているのです。
研究の女神は
楽観主義者に微笑みかける
審良 振り返られてみて、鍋島先生のなかで、ここまでで最も中心的な研究はなんだったでしょうか。
鍋島 やはり発生分化のしくみの解明に向けて最初に取り組んだ筋細胞の研究です。このしくみの研究には自分なりに納得しています。一方、ラボに参加してくれたスタッフには“自分のやりたいことを”と言い続けました。そして多くの生命現象に取り組む中で全体の姿が垣間見えるようになってきたのです。本日紹介できなかったことが沢山あります。みなさん素晴らしかった。私はそれを楽しんでいたのです。とても一筋の道とはいえません、時折お叱りを受けていますが。
審良 私もいろいろなことをしてきたけれど、最後になにか一つ自分がやったといえるものがほしいと思い、Toll様受容体のシグナル伝達経路の研究に取り組みました。それ以前、岸本忠三先生(千里ライフサイエンス振興財団名誉理事長)の研究室でやっていた研究はやっぱり岸本先生のものであり、自分のものとは思いませんでした。
鍋島先生は、どんなことを思いつづけながら歩んでこられたのでしょうか。
鍋島 私には先生にとっての岸本先生のような存在はありません。それはそれで大変だろうなと思いつつ、羨ましいと感じてもいました。「科学の歴史に位置づけられることをやりたい」「基本命題の解明に貢献したい」ということはさきほど言いましたが、もう一つ、「研究の女神は楽観主義者に微笑みかける」とも思ってきました。何事も楽観的にやってきました。そして「失うものなど何も無い、捨てる神あれば拾う神あり」とも。もちろん多くの素晴らしい先生方との触れ合いは貴重なものですが、でも何があっても頼らないと。ある意味での一匹狼、背水の陣でした。
審良 若者にどんなことを伝えたいですか。
鍋島 よく「運鈍根感」が大切だと言っています。“愚鈍に、時には感性鋭く、絶えず根気よく、そして心の準備のあるところに時折舞い降りる幸運を味方にして”と。そして“幸運を捕まえられるかどうかはあなた次第です”とも言っています。私は幸運の女神との二人三脚でした。
審良 本日は、多岐にわたるお話をありがとうございました。
(対談日/2024年7月3日)
EYES
動物個体の形成と
機能維持のしくみを次々と解明
選択的スプライシング、Myogenin、
そしてKlotho
動物個体は受精、発生、形態形成を経て誕生し、発達、成熟、機能維持、そして機能減退へと進み、死を迎えます。そこにある生命のしくみは、未解明だった部分に研究者が光を照らして解明してきたからこそ、精緻なものであることがわかってきました。
今回の「LF対談」に登場する鍋島陽一氏は、分子遺伝学を基盤としながら、動物の形成と機能維持にかかわる数々のしくみを解明してきました。そこには、「基本的な命題を解明する」という一貫した考えがあります。
遺伝情報はメッセンジャーRNA配列へと転写され、この配列情報に基づいてタンパク質が合成されます(翻訳)。メッセンジャーRNAは長い前駆体RNAとして転写されます。前駆体RNAにはタンパク質へと翻訳される配列(エクソン)と翻訳されない配列(イントロン)が飛び飛びに含まれており、翻訳されるエクソン配列部分のみを繋ぎ合わせることによりメッセンジャーRNAが合成されます。この繋ぎ合わせる仕組みをスプライシング(貼り継ぎ現象)と呼んでいます。鍋島氏は1984年、骨格筋ミオシン軽鎖というタンパク質は単一遺伝子にコードされているもののミオシン軽鎖1と3になること、すなわち1遺伝子から2つのタンパク質が合成されることを発見し、その仕組みを報告しました。驚いたことにスプライシングの際に数あるエクソンのうちのいくつかが選ばれ、いくつかが選ばれないという現象が起きていたのです。これを「選択的スプライシング」といい、エクソンの選ばれ方により異なるタンパク質となります。それまで1遺伝子から1タンパク質が合成されると考えられていましたが1遺伝子から複数のタンパク質が合成されることとなり概念が覆されたのです。選択的スプライシングの発見により鍋島氏は限られた遺伝子から多様なタンパク質を生みだす基本原理を見出したのです。
筋肉細胞の形成に目を向けてみると、MyoD 、Myogenin、Myf5 遺伝子は中胚葉性未分化細胞を筋細胞へと誘導することで大変注目されました。しかし、これらの遺伝子がどのような関係性をもって筋肉細胞をつくるかは解明されていませんでした。鍋島氏はノックアウトマウスをほかの多くの研究者に先駆けてつくり、Myogenin遺伝子をノックアウトしたマウスでは筋芽細胞は作られるが筋管細胞が作られないことを発見しました。当時の競争相手だった世界の研究者らとともに、Myf5とMyoDは筋芽細胞をつくり、筋芽細胞を分化した筋管細胞に誘導するのはMyogeninであるとの機構の解明に貢献したのです。
生体内ではカルシウムは極めて重要な役割を担っており、その血中濃度は厳密に制御されることにより恒常性が保たれています。もし、カルシウム濃度が異常になると細胞機能の低下や細胞死が生じてしまいます。生命にとって重要なカルシウム恒常性を制御する因子の一つが、鍋島氏の同定したα-Klothoです。1997年、鍋島氏はヒトの老化に似た多様な変異表現型を示すマウスを発見し、α-Klothoを同定しました。以降、α-Klothoの作用機序の解明に取り組みます。その結果、エンドソームに蓄積されているα-KlothoとNa+,K+-ATPaseの複合体が、細胞外カルシウム濃度の低下に応答して直ちに細胞表面へ移動し、Na+の濃度勾配や膜電位の変化が誘導され、腎臓でのカルシウムの再吸収・輸送、副甲状腺でのPTHの分泌、脳の脈絡膜を介した血液から脳脊髄液へのカルシウム輸送が誘導され、血液や脳脊髄液のカルシウム濃度が制御されることを示しました。また、細胞膜型のα-Klothoは、FGF23、FGFR1と複合体を形成し、カルシウム代謝制御の鍵を握るビタミンDの合成を抑えます。また、リンの再吸収を制御しています。これらの解析によりカルシウムの恒常性は時間軸に沿った多段階の反応の組み合わせとフィードバック機構で制御されていることを提唱しました。鍋島氏はまた、β-Klothoを同定し、β-Klothoが肝臓において胆汁酸を負に制御する機構や母体から胎児へのコレステロール輸送を制御する機構なども解明しています。
ギリシャ神話において「クロトー」は人の運命を司る三女神の一つであり、生命の誕生に立ち会い、生命の糸を紡む女神と伝えられます。遺伝子にKlothoの名をつけた鍋島氏は、生命の機能を維持するために欠かせないこの遺伝子に、女神の姿を重ねてきたようです。
その後も鍋島氏は現在にかけて、加齢や老化のしくみの解明といった基礎研究ともに、認知症の簡便な評価法の開発といった応用研究にも精力的に取り組んでいます。